(15分)化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为_______________。
(2)已知反应Fe(s)+CO2(g) FeO(s)+CO(g)ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
FeO(s)+CO(g)ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
| 温度(℃) |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
①该反应的化学平衡常数K的表达式为 ,a________0(填“>”、“<”或“=”)。在500 ℃ 2 L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为________,生成CO的平均速率v(CO)为_______________。
②700 ℃反应达到平衡后,要使反应速率增大且平衡向右移动, 可采取的措施有 。
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=(溶液电解前后体积的变化忽略不计)。

牛奶放置时间长了会变酸,这是因为牛奶中含有的乳糖,在微生物的作用下分解变成了乳酸。乳酸最初就是从酸牛奶中得到并由此而得名的。乳酸的结构简式为 。完成下列问题:
。完成下列问题:
(1)写出乳酸分子中官能团的名称:____________________。
(2)写出乳酸与足量金属钠反应的化学方程式:___________________。
(3)写出乳酸与碳酸钠溶液反应的化学方程式:________________________。
(4)乳酸在浓硫酸作用下,两分子相互反应生成环状结构的物质,写出此生成物的结构简式:____________。
观察下图中物质分子的比例模型及其变化,回答下列问题。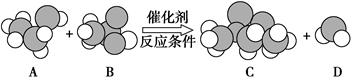
(1)A是乙醇,则B的名称是____________,
C的结构简式是____________________________。
(2)上图所示化学方程式中的“反应条件”是___________________。
(3)反应物中只有乙醇分子中的氧原子是18O,生成物中含这种氧原子的物质是(写物质名称)______________ _。
(4)在B的分子中,最外层电子数为8的原子共有________个。
某有机物的结构简式为HOOC—CH=CHCH2OH。
(1)请你写出该有机物所含官能团的名称:________、________、________。
(2)验证该有机物中含有—COOH官能团常采用的方法是__________________,
产生的现象为____________________。
如图是A分子的球棍模型和B分子的比例模型,回答下列问题:
(1)A和B的关系是_____。
(2)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式___________。
(3)写出B分子和金属钠反应的化学方程式_____________________。
(4)B在加热条件下能够和HBr发生反应生成溴乙烷,该反应类型是____________。
某烃A不能使溴水褪色,0.5 mol A完全燃烧时,得到1.5 mol H2O和67.2 L CO2(标准状况)。
(1)A的结构简式为___________________。
(2)根据下列条件写出有关反应的化学方程式。
①在催化剂FeCl3的作用下,A与Cl2反应生成B:________________。
②在催化剂作用下,A与H2反应生成C:__________。