【化学——选修5:有机化学基础】化合物H可用以下路线合成:

已知:
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以生成88gCO2和45gH2O,且A分子结构中有3个甲基,则A的结构简式为 ;
(2)B和C均为一氯代烃,D的名称(系统命名)为 ;
(3)在催化剂存在下1molF与2molH2反应,生成3—苯基—1—丙醇。F的结构简式是 ;
(4)反应①的反应类型是 ;
(5)反应②的化学方程式为 ;
(6)写出 与G具有相同官能团的芳香类同分异构体(其中核磁共振氢谱为5种)可能的结构简式 。
苯环上原有取代基对苯环上再导入另外取代基的位置有一定影响。其规律是
(1)苯环上新导入的取代基的位置主要决定于原有取代基的性质;
(2)可以把原有取代基分为两类: ①原取代基使新导入的取代基进入苯环的邻、对位;如:-OH、-CH3(或烃基)、-Cl、-Br等;②原取代基使新导入的取代基进入苯环的间位,如:-NO2、-SO3H、-CHO等。现有下列变化:(反应过程中每步只能引进一个新的取代基)
(1)请写出其中一些主要有机物的结构简式:
A B C D
(2)写出①②两步反应方式: 。
A、B是相对分子质量不相等的两种烃,无论二者以何种比例混合,只要混合物的总质量不变,完全燃烧后所产生的CO2的质量就不变。
(1)试写出两组符合上述情况的烃的结构简式:
________________和________________;________________和________________。
(2)A、B应满足的条件是________________________________________________。
1丁炔的最简式是________,它与过量溴加成后产物的结构简式是________;有机物A的分子式与1丁炔相同,而且属于同一类别,A与过量溴加成后产物的结构简式是________;与1丁炔属于同系物且所含碳原子数最少的有机物的名称是________,它能发生________(填反应类型)反应制造导电塑料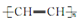 ,这是21世纪具有广阔前景的合成材料。
,这是21世纪具有广阔前景的合成材料。
取8 g某有机物A(相对分子质量为32)在氧气中燃烧,生成物中只有11 g的CO2和9 g H2O,则A中一定含有______________元素,其分子式是______________;误服A会使人中毒眼睛失明甚至死亡,其化学名称为______________,写出此物质在空气中燃烧的化学方程式:_____________________________。
除去下列物质中的杂质(括号内为杂质),试选用合适的试剂进行填空。(填写字母序号)
选择的试剂:
| A.盐酸 | B.水 | C.饱和食盐水 | D.AgNO3溶液 E.NaOH溶液 |
F.氯水 G.硫酸铜溶液 H.硫酸溶液 I.铁 J.CO2
(1)FeCl3溶液(FeCl2)________,
(2)NaHCO3溶液(Na2CO3) ,
(3)NaNO3溶液(NaBr)________,
(4)SiO2(CaCO3固体) ,
(5)Mg(Al)________________