还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
已知转化过程中的反应为
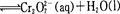
转化后所得溶液中铬元素的含量为28.6 g/L, CrO42-有10/11转化为Cr2072-,下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
| B.若用绿矾(FeS04·7H2O)作还原剂,处理1 L废水,至少需要458.7g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 |
| D.常温下Ksp=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
把一定量铜粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+浓度恰好相等。则Cu2+和未反应的Fe3+的物质的量之比为
| A.1:1 | B.1:2 | C.2:3 | D.3:2 |
下列各组物质中分子数一定相同的是
| A.2 g O3和2g O2 |
| B.9g H2O和0.5NA个CO2 |
| C.标准状况下1 mol O2和22.4 L H2O |
| D.0.2 mol H2和4.48 L HCl |
下列离子方程式中正确的是
| A.铁粉加入稀硫酸中:2Fe+6H+===2Fe3++3H2↑ |
| B.Na2O2与H2O反应制备O2:Na2O2+H2O = 2Na++2OH-+O2↑ |
| C.硫酸铜与Ba(OH)2溶液反应:Cu2++ 2OH-=Cu(OH)2↓ |
| D.实验室用大理石和稀盐酸制取CO2:2H++CaCO3==Ca2++CO2↑+H2O |
下列能达到实验目的的是
| A.用KSCN溶液检验硫酸亚铁溶液是否氧化变质 |
| B.用量筒测得排水法收集制得的氢气体积为50.28 mL |
| C.向1 mol·L-1氯化铁溶液中加入NaOH溶液制取氢氧化铁胶体 |
| D.将74.5g氯化钾溶于1L水中所得溶液物质的量浓度为1 .00mol·L-1 |
下列溶液中 的物质的量浓度最大的是
的物质的量浓度最大的是
| A.500 mL 1 mol·L-1的KNO3溶液 |
| B.500 mL 1 mol·L-1的Ba(NO3)2溶液 |
| C.1000 mL 0.5 mol·L-1的Mg(NO3)2溶液 |
| D.1 L 0.5 mol·L-1的Fe(NO3)3溶液 |