ClO2是一种高效、广谱、安全的杀菌、消毒剂,易溶于水。制备方法如下:
(1)步骤Ⅰ:电解食盐水制备氯酸钠。用于电解的食盐水需先除去其中的 Ca2+、Mg2+、SO42-等杂质。在除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的________和NaOH,充分反应后将沉淀一并滤去。
(2)步骤Ⅱ:将步骤Ⅰ得到的食盐水在特定条件下电解得到氯酸钠(NaClO3),再将它与盐酸反应生成ClO2与Cl2,ClO2与Cl2的物质的量比是____________。
(3)学生拟用左下图所示装置模拟工业制取并收集ClO2,用NaClO3和草酸(H2C2O4)恒温在60℃ 时反应制得。
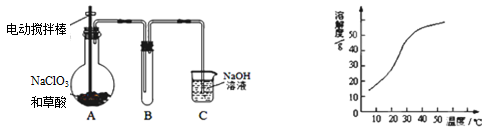
反应过程中需要对A容器进行加热,加热的方式为____________;加热需要的玻璃仪器除酒精灯外,还有 ;
(4)反应后在装置C中可得亚氯酸钠(NaClO2)溶液。已知NaClO2饱和溶液在温度低于38℃时,析出的晶体是NaClO2·3H2O,在温度高于38℃时析出的是NaClO2。根据右上图所示NaClO2的溶解度曲线,请完成从NaClO2溶液中制得NaClO2·3H2O的操作步骤:
① ;② ;③洗涤;④干燥。
(5)目前我国已成功研制出利用NaClO2制取二氧化氯的新方法,将Cl2通入到NaClO2溶液中。现制取270kg二氧化氯,需要亚氯酸钠的质量是________。
(6)ClO2和Cl2均能将电镀废水中的剧毒CN-氧化为无毒物质,自身被还原为Cl-。处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的_______倍。
实验桌上只有烧碱、盐酸、铜片、大理石、蒸馏水五种试剂,从欠缺试剂的角度来看(实验仪器齐全),无法进行的实验项目是
| A.制取氢气 | B.制取碳酸钠 |
| C.制取氯化铜 | D.测定盐酸的浓度 |
如图所示是一套实验室制气装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是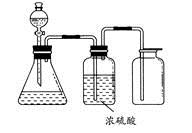
| A.铜屑和稀硝酸 |
| B.二氧化锰和浓盐酸 |
| C.用浓氨水和生石灰反应 |
| D.碳酸钙和稀盐酸 |
可用如图所示装置制取、净化、收集的气体是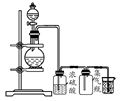
| A.锌和稀硝酸反应制一氧化氮 |
| B.亚硫酸钠与浓硫酸反应制二氧化硫 |
| C.铁和稀硫酸反应制氢气 |
| D.浓氨水和生石灰反应制取氨气 |
下列实验方案正确且能达到相应实验预期目的的是
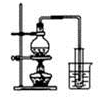 |
 |
 |
 |
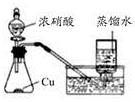
| A.制取少量蒸馏水 |
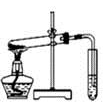
B.制取少量NO2 |
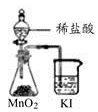
C.比较MnO2、Cl2、I2的氧化性 |
D.探究NH4HCO3的热稳定性 |
下列药品和装置合理且能完成相应实验的是

| A.喷泉实验 |
| B.实验室制取并收集氨气 |
| C.制备氢氧化亚铁 |
| D.验证苯中是否有碳碳双键 |