设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,11.2L HF中含有分子的数目为0.5NA |
| B.0.1molFe与少量氯气反应生成FeCl2,转移电子数为0.2NA |
| C.1.4g 由乙烯和环丙烷组成的混合物中含有原子的数目为 0.3NA |
| D.0.1 mol·L-1碳酸钠溶液中含有CO32-离子数目小于0.1 NA |
将浓度为0.1mol/L HF溶液加水不断稀稀释,下列各量始终保持增大的是
| A.c(H+) | B.K2(HF) | C.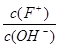 |
D.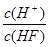 |
水中加入下列溶液对水的电离平衡不产生影响的是
| A.NaHSO4溶液 | B.NaCl溶液 | C.KAl(SO4)2溶液 | D.KF 溶液 |
下列电离方程式不正确的是
| A.NaHCO3=Na++HCO3- |
| B.NaHSO4=Na++H++SO42- |
C.HCO3-+H2O H3O++CO32- H3O++CO32- |
D.H3PO4 3H++PO43- 3H++PO43- |
下列图示关系中不正确的是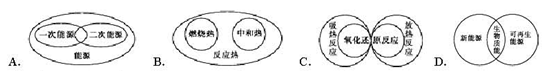
下列说法不正确的是()
| A.李比希燃烧法、钠熔法、铜丝燃烧法都是用来分析有机物元素组成的方法 |
| B.红外光谱法、紫外光谱法、核磁共振、质谱仪等都是现代化学测定有机物结构的常用方法 |
| C.同位素示踪法是研究化学反应历程的手段之一 |
| D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别 |