(14分)丙烯酸乙酯(Ⅳ)是合成塑料、树脂等高聚物的重要中间体,可由下面路线合成:

(1)反应②属于 反应,1molⅣ完全燃烧消耗O2为 mol.
(2)Ⅱ含有的官能团名称为 ,Ⅱ能使溴水褪色,其反应方程式为 .
(3)Ⅰ可以由Ⅴ(分子式为C3H6O)催化氧化得到,则Ⅴ→Ⅰ的反应方程式为 (注明反应条件).
(4)Ⅵ是Ⅳ的一种无支链的同分异构体,且碳链两端呈对称结构.则Ⅵ的结构简式为 .
(5)一定条件下,化合物  也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为 .
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为 .
下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
⑥ |
⑦ |
bl |
|||||
| 三 |
① |
③ |
⑤ |
⑧ |
⑩ |
|||
| 四 |
② |
④ |
⑨ |
(1)11种元素中,化学性质最不活泼的是________。
(2)①②⑤中,最高价氧化物对应的水化物碱性最强的是________。
(3)元素⑦的氢化物分子式为________,该氢化物与元素①的单质反应的离子方程式是_______________________________________________。
(4)①的最高价氧化物对应的水化物的化学式为__________。①和⑨两元素形成化合物的化学式为_________________________,该化合物灼烧时焰色为________,该化合物的溶液与元素⑧的单质反应的离子方程式为。
现有
| A.二氧化硅 | B.三氧化二铁 | C.二氧化硫 | D.三氧化二铝。 |
请你根据已有的知识,选择合适的物质,用字母代号填空:
(1)能形成酸雨的是;(2)光纤制品的基本原料;
(3)属于两性氧化物的是;(4)红棕色固体是。
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。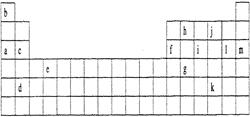
(1)下列(填写编号)组元素的单质可能都是电的良导体。
①a、c、h②b、g、k③c、h、1④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力,②形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| 锂 |
X |
Y |
|
| 失去第一个电子 |
519 |
502 |
580 |
| 失去第二个电子 |
7296 |
4570 |
1820 |
| 失去第三个电子 |
11799 |
6920 |
2750 |
| 失去第四个电子 |
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:。
②表中的X可能为以上13种元素中的(用字母序号填写)元素,这种元素和j形成的化合物中若存在共价键,则该化合物的电子式是,这种物质属于(填“离子”或“共价”)化合物。
③Y在周期表中是族的元素。
④在以上13种元素中,(用字母序号填写)元素原子失去核外第一个电子需要的能量最多。
有A、B、C、D、E、F六种短周期的主族元素、原子序数依次增大,其中A、D元素的原子最外电子层均只有一个电子,且A和D可形成离子化合物;C、F同主族,B元素位于元素周期表中第二周期,且原子最外层电子数占核外电子总数的3/4,F元素原子最外电子层比同周期的E元素原子的最外电子层多4个电子,请回答:
(1)写出A、D两种元素组成的化合物的电子式;
(2)写出B、D、E三种元素组成的常见化合物的名称;
(3)工业生产E的方法是;
(4)D、E、F三元素最高价氧化物对应的水化物相互之间发生反应的离子方程式为:
、
、
。
请按要求填空:
I.现有:①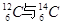 、②O2与O3、③正丁烷与异丁烷、④金刚石与石墨、⑤冰与水、⑥乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是;(2)互为同素异形体的是;(3)互为同分异构体的是;(4)属于同一化合物的是。
、②O2与O3、③正丁烷与异丁烷、④金刚石与石墨、⑤冰与水、⑥乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是;(2)互为同素异形体的是;(3)互为同分异构体的是;(4)属于同一化合物的是。
II.现有下列五种物质:①Ar②CO2③SiO2④NaOH⑤K2S,请按要求用序号填空:
(1)属于离子晶体的是,属于原子晶体的是,属于分子晶体的是;
(2)只含共价键(不含分子间作用力)的是,只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。