A,B,C,D为四种短周期元素,已知A, C同主族,B,C,D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是
| A.原子序数:A>C>B>D | B.简单离子半径:D>B>C>A |
| C.与水反应时,B比D更剧烈 | D.最高价氧化物对应水化物酸性A>C |
在一定条件下NO2与SO2气体发生反应,NO2(g)+SO2(g) SO3(g)+NO(g)ΔH=-41.8kJ·mol-1。将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
SO3(g)+NO(g)ΔH=-41.8kJ·mol-1。将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
| A.混合气体颜色保持不变 | B.体系压强保持不变 |
| C.SO3和NO的体积比保持不变 | D.每消耗1 mol SO3的同时生成1 mol NO2 |
已知:2H2(g)+O2(g) ="==" 2 H2O (l)△H= -571.6 kJ· mol-1,下列说法正确的是
| A.2 L液态水分解成2L氢气与1L氧气吸收571.6kJ热量 |
| B.2 mol氢气与1mol氧气反应生成2mol气态水放出热量大于571.6kJ |
| C.在相同条件下,2 mol氢气与1mol氧气的能量总和大于2mol液态水的能量 |
| D.使用催化剂能降低该反应的活化能使反应放出得热量小于571.6kJ |
反应A2(g) + 3B2(g)  4C2(g) + 2D2 (g)在5L密闭容器中进行,半分钟后,C2的物质的量增加了0.3mol,则此反应的平均速率
4C2(g) + 2D2 (g)在5L密闭容器中进行,半分钟后,C2的物质的量增加了0.3mol,则此反应的平均速率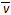 x
x
A.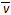 (B2) =" 0.01mol·(L·s)" –1 (B2) =" 0.01mol·(L·s)" –1 |
B.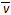 (C2) =" 0.002mol·(L·s)" –1 (C2) =" 0.002mol·(L·s)" –1 |
C.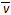 (D2) =" 0.006mol·(L·s)" –1 (D2) =" 0.006mol·(L·s)" –1 |
D.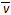 (A2) =" 0.008mol·(L·s)" –1 (A2) =" 0.008mol·(L·s)" –1 |
下列物质属于电解质的是()
①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融NaOH ⑥盐酸 ⑦乙酸
⑧NH3·H2O ⑨三氧化硫
| A.①②⑥⑧ | B.②⑤⑦⑧ | C.②⑤⑥⑦ | D.②④⑤⑨ |
下列热化学方程式中,△H能正确表示物质的燃烧热的是
| A.2CO(g) +O2(g) ==2CO2(g)△H=—566.0 kJ/mol |
| B.C(s) +1/2O2(g) ==CO(g)△H=—110.5 kJ/mol |
| C.CH4(g) +2O2(g)="=" CO2(g)+2H2O(l)△H=—890.31 kJ/mol |
| D.2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l)△H=—11036 kJ/mol |