下列三个实验均可证明CO2能与NaOH溶液反应.
实验Ⅰ:用试管集满CO2,迅速加入NaOH溶液、塞紧橡皮塞,充分振荡,静置.
(1)实验后打开橡皮塞时,听到响亮的“啵”声,其原因是实验后试管中的气压 (填“变大”或“变小”);
(2)对静置后的溶液进行下列操作,由对应的现象可推知CO2与NaOH溶液一定反应的是 (填序号).
A.滴加酚酞,溶液变为红色
B.滴加少量稀盐酸,不产生气泡
C.滴加少量氯化钡溶液,产生白色沉淀
实验Ⅱ:在8.0g NaOH固体中加入适量95%的乙醇溶液,配制成饱和NaOH的乙醇溶液,向该溶液中通入CO2,直至产生白色沉淀Na2CO3.
(1)某托盘天平标尺的最大刻度为1g,配备有1g、2g、5g和10g四种砝码若干个,用该天平称取8.0g NaOH固体时,所需砝码总数为 个;
(2)实验Ⅱ利用的原理是: 影响物质的溶解性.
实验Ⅲ:如图所示,将5mL溶质质量分数为10%的NaOH溶液(ρ≈1.1g/mL)缓慢、全部注射入瓶中,观察到酒精倒流入瓶中,最终瓶中剩余5mL气体.此实验条件下,1体积水约可溶1体积CO2,CO2不溶于酒精,ρ(CO2)≈2gL.

(1)实验时 (填“能”或“不能”)用水代替量筒中的酒精;
(2)实验时将NaOH溶液缓慢注射入瓶中的原因是 ;
(3)根据上述实验可推知:与NaOH溶液反应的CO2约为 (取整数)mL;
(4)理论上,上述5mL NaOH溶液与足量CO2反应都转化为Na2CO3时,参加反应的CO2的体积大约为多少毫升?(写出计算过程,结果取整数)
(5)实际上,上述NaOH溶液吸收的CO2偏少,其原因可能是 (填序号).
A.CO2不纯
B.装置漏气
C.NaOH与CO2化合生成了NaHCO3
d.倒流入瓶中的酒精干扰了NaOH溶液对CO2的吸收.
一种"环保石头纸"开始被人们使用,其主要成分是碳酸钙。某班同学对它产生了浓厚的兴趣,把"环保石头纸"带到实验室,完成了如右图所示的两个实验。请回答问题:
(1)实验一:试管中产生大量的气泡,烧杯中澄清的石灰水变浑浊,请写出"环保石头纸"与稀盐酸发生反应的化学方程式(假设"环保石头纸"中的其他成分既不溶于水,又不与盐酸发生反应);
(2)实验二:试管中有白色沉淀产生。小刚同学想探究该实验反应后溶液中溶质的成分。
提出猜想:
猜想①:
、
和
;
猜想②: ;
猜想③: 和 。
同学们经过讨论排除了猜想,理由是。
有同学认为小刚的猜想不全面,又提出猜想④:
和
,并通过实验验证了该猜想成立。请你将实验报告补充完整。
| 实验操作 | 实验现象 | 实验结论 |
| 取实验二反应后的上层清液少量于试管中,滴加少量. |
|
猜想④成立 |
(3)实验结束后,未经处理的废液(填"能"或"不能")直接倒入下水道。
探究1。物质的回收和利用
某化学探究小组的同学从实验废液中回收铜,得到的铜粉样品中含有少量的铁粉。为了除去铁粉,同学们设计了两个实验方案:
方案一:铜样品 过滤
过滤 洗涤
洗涤 干燥
干燥
方案二:铜样品 过滤
过滤 洗涤
洗涤 干燥
干燥
(1)对于上述两个方案,你的评价是:。(写一条)
(2)写出其中的一个反应化学方程式:。
(3)在干燥时,有同学提出用酒精灯加热将铜粉烘干。小明马上提出反对意见,其理由是
(用化学方程式表示出来)。
探究2:物质的鉴别和提纯
实验操作考试时,小王同学用稀盐酸、BaCl2溶液、酚酞溶液来检验四瓶无标签的溶液:Na2CO3、NaCl、Na2SO4、澄清石灰水。
(1)请你帮助小王同学完成澄清石灰水的鉴别:
(2)实验结束后,他将废液倒入同一烧杯中,发现废液为红色且呈浑浊状态,则使废液呈
红色的离子是(写离子符号)。废液中一定不含有的溶质是(写化学式)。
(3)小王同学想提纯烧杯中含有的氯化钠,他提出以下方案:
①加入过量的BaCl2溶液,
②加入过量的Na2CO3溶液,其目的是除去可能存在的和过量的
BaCl2。
③过滤,
④向滤液中逐滴加入盐酸至为止,其目的是除去;
⑤蒸发结晶,即得氯化钠。
(4)写出上述实验过程中的一个有沉淀生成的化学方程式:
。
潜水艇有两种供氧的装置,第一种是储备压缩氧气,第二种是在紧急的情况下才使用的过氧化钠(
)做供氧剂,小红同学对过氧化钠如何做供氧剂产生浓厚的兴趣,于是他在老师的指导下展开了以下的探究活动。
[查阅资料]
1.过氧化钠是用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的
转换成
,以供呼吸之用。
2.二氧化碳与过氧化钠反应的生成物只有两种,一种是氧气,另一种是化合物。
3.人呼出的气体中含有的水分也能与过氧化钠反应生成氧气。
(1)小红利用下图的BCDE装置组合和有关药品制取并收集氧气。

若用大理石与稀盐酸制取二氧化碳,则B中装置可采用上图中的(填数字序号,下同);E中装置可采用上图中的;B中的化学方程式为。
(2)二氧化碳与过氧化钠反应除生成氧气还生成什么物质?
[作出猜想]二氧化碳与过氧化钠反应生成的化合物到底是什么物质?小红作出了以下三种猜想:
①是碳酸②是氢氧化钠③是碳酸钠
通过对反应物有关的元素组成的分析,乙同学认为猜想(填数字序号)一定是错误的,理由是。
[进行实验]小红通过以下实验验证了另一个猜想的正确性,请完成下述实验报告。
[反思与交流]
①小红若用图A来代替B装置,证明二氧化碳与过氧化钠反应生成了氧气,你是否同意小红的做法?(填"是"或"否")原因:。
某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰。该小组同学进行了如下探究。
(1)写出铁丝在氧气中燃烧的文字表达式:。
(2)探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如右图所示)。由此可知:蜡烛燃烧产生的火焰是由(填“固态”或“气态”)物质燃烧形成的。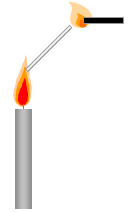
(3)探究二:物质燃烧产生火焰的根本原因是什么?
【查阅资料】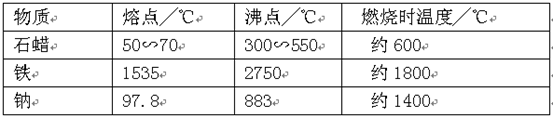
由上表可知:物质燃烧能否产生火焰与其(填“熔点”或“沸点”)和燃烧时温度有关。由此推测:钠在燃烧时,(填“有”或“没有”)火焰产生。
(5分)某校研究性学习小组用右下图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%。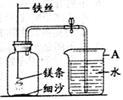
(1)燃烧、冷却后打开止水夹,水能进入集气瓶的原因是 。
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的 %。现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中还一定有 。
【发现问题】该气体是怎样减少的呢?
【假设】该气体与镁条反应而减少。
【查阅资料】镁条是一种化学性质比较活泼的金属,在氮气中能燃烧,产物为氮化镁(Mg3N2),镁条还可以在二氧化碳气体中燃烧生成碳和氧化镁。
【交流与反思】集气瓶中放少量细沙的目的是 ,产物氮化镁的状态应为 。