下列说法正确的是
| A.第ⅠA族元素是周期表中金属性最强的金属元素 |
| B.两个非金属原子间不可能形成离子键 |
| C.HF、HCl、HBr和HI的热稳定性和还原性依次减弱 |
| D.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
在一个容积固定的密闭容器中充入1 mol SO3气体,建立如下平衡:2SO3(g) 2SO2(g)+O2(g),测得SO3的转化率为a%。其他条件不变,在上述平衡体系中再充入1 mol SO3气体,达到新的平衡时SO3的转化率为b%,则a、b的关系为()
2SO2(g)+O2(g),测得SO3的转化率为a%。其他条件不变,在上述平衡体系中再充入1 mol SO3气体,达到新的平衡时SO3的转化率为b%,则a、b的关系为()
| A.a>b | B.a<b | C.a="b" | D.无法确定 |
同时符合下列两个图象的反应(v表示反应速率,v%表示某气态生成物的体积分数)是( )
A.N2O3(g) NO2(g)+NO(g);ΔH>0 NO2(g)+NO(g);ΔH>0 |
B.CO2(g)+C(s) 2CO(g);ΔH>0 2CO(g);ΔH>0 |
C.3NO2(g)+H2O(l) 2HNO3(l)+NO(g);ΔH<0 2HNO3(l)+NO(g);ΔH<0 |
D.4NH3(g)+5O2(g) 4NO(g)+6H2O(l);ΔH<0 4NO(g)+6H2O(l);ΔH<0 |
右图表示在密闭容器中C(s)+H2O(g) CO(g)+H2O(g)(正反应吸热),反应达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况,据图可知,改变的条件是( )
CO(g)+H2O(g)(正反应吸热),反应达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况,据图可知,改变的条件是( )
| A.增加CO浓度 | B.升高温度 | C.增大压强 | D.增加水蒸气 |
在高温下,反应2HBr(g) H2(g)+Br2(g)(正反应为吸热反应)达到平衡时,要使混合物气体的颜色加深,可采用的反应条件是( )
H2(g)+Br2(g)(正反应为吸热反应)达到平衡时,要使混合物气体的颜色加深,可采用的反应条件是( )
| A.减小压强 | B.缩小体积 |
| C.升高温度 | D.增大氢气的浓度 |
已知下列化学反应:
3A(g)+B(g) C(s)+4D(g);正反应放热图中a、b分别表示在一定条件下,D的体积分数〔φ(D)〕随反应时间t的变化情况。若使曲线b变为曲线a,可采取的措施是( )
C(s)+4D(g);正反应放热图中a、b分别表示在一定条件下,D的体积分数〔φ(D)〕随反应时间t的变化情况。若使曲线b变为曲线a,可采取的措施是( )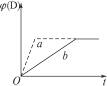
A.增大B的浓度B.降低反应温度
C.缩小容器体积 D.加入催化剂