(14分)亚硝酸是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化为Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白中含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。说明维生素C具有 性,亚硝酸盐具有 性(填“氧化”或“还原”)
(2)NaNO2和NaCl外观相似,肉眼不易分辨。下列方法中,不能用来区分NaNO2和NaCl的是 。
| A.分别测定这两种溶液的pH值 |
| B.酸性条件下分别将两种溶液加热 |
| C.在酸性条件下分别加入KI-淀粉溶液 |
| D.分别向两种溶液中滴加AgNO3溶液 |
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,请写出该反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,是理想的水处理剂,其与水反应生成O2、Fe(OH)3(胶体)和KOH。
① KOH的电子式
② O2的结构式
③ K2FeO4中Fe的化合价为
④上述反应的离子方程式
实验室用氯酸钾和二氧化锰制取氧气的反应方程式为:
2KClO3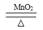 2KCl+3O2↑
2KCl+3O2↑
回答下列问题:
(1)该反应中被氧化的元素名称为_________,还原产物的化学式是________,生成1molO2时转移电子的数目是____________。
(2)从反应后的固体混合物中分离出难溶于水的MnO2具体操作步骤:____________。
(3)分离出的MnO2可用于实验室制取Cl2,化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,其离子方程式为____________。
MnCl2+Cl2↑+2H2O,其离子方程式为____________。
(4)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为_______。
(5)以上两个反应都用到MnO2,其作用分别是________、________。
已知2A2(g)+B2(g) 2C3(g) △H="—akJ/mol" (a>0),在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应达平衡后,C3的浓度为w mol/L,放出热量b kJ.
2C3(g) △H="—akJ/mol" (a>0),在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应达平衡后,C3的浓度为w mol/L,放出热量b kJ.
(1)比较a________b( 填>、=、<);
(2)若将反应温度升高到700℃,反应的平衡常数将________(增大、减小或不变);
(3)能说明该反应已经达到平衡状态的是________
a、V(C3)=2V(B2);b、容器内压强保持不变
c、V逆(A2)=2V正(B2)d、容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________
a、及时分离出C3气体; b、适当升高温度;
c、增大B2的浓度; d、选择高效的催化剂
300℃时,将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应3A(g)+B(g) 2C (g)+2D(g) △H=Q,2min末达到平衡,生成生成0.8mol D.
2C (g)+2D(g) △H=Q,2min末达到平衡,生成生成0.8mol D.
(1)300℃时,该反应的平衡常数表达式为:K=__________________;已知K300℃<K350℃,则△H______0(填“>”或“<”)。
(2)在2min末时,B的平衡浓度为_____________,D的平均反应速率为____________;
(3)若温度不变,缩小容器容积,则A的转化率___________(填“增大”、“减小”或“不变”),原因是___________;
气态可逆反应:mA(g)+nB(g) pC (g)+qD(g),符合下图。试用“>”或“<”填(1)~(3)题。
pC (g)+qD(g),符合下图。试用“>”或“<”填(1)~(3)题。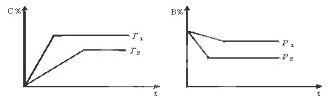
(1)温度T1___________T2,
(2)压强p1___________ p2,
(3)m+n____________ p+q,
(4)正反应为___________反应(填“放热”或“吸热”)。
25℃、101kPa时,一些物质的燃烧热为:
| 化学式 |
CO(g) |
H2(g) |
CH3OH(l) |
| △H/( kJ•mol-1) |
-283.0 |
-285.8 |
-726.5 |
请回答下列问题:
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:_____________________;
(2)根据盖斯定律完成反应的热化学方程式:CO(g)+2H2(g)═CH3OH(l)△H=_____________。