铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程: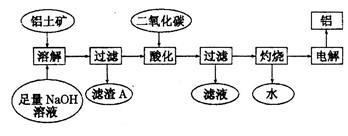
已知:
①铝土矿的主要成分是A12O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的Na2SiO3与Na[Al(OH)4]),能生成硅铝酸盐沉淀,化学反应方程式为:
2Na2SiO3+2 Na[Al(OH)4]=Na2A12Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氧氧化钠溶液后,该步操作中主要发生反应的离子方程式:_______。
(2)滤渣A的主要成分为_________;滤渣A的用途是(只写一种)_________________。
人们对苯及芳香烃的认识有一个不断深化的过程。
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为C6H6的一种含两个三键且无支链的链烃的结构简式___________________________________________
__________________________________________________________________。
(2)已知分子式为C6H6的结构有多种,其中的两种为
(Ⅰ)  (Ⅱ)
(Ⅱ)
①这两种结构的区别表现在:
定性方面(即化学性质方面):Ⅱ能________(填字母编号)而Ⅰ不能。
A.被酸性高锰酸钾溶液氧化
B.能与溴水发生加成反应
C.能与溴发生取代反应
D.能与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6与H2加成时,Ⅰ需__________mol ,而Ⅱ需__________mol。
②今发现C6H6还可能有另一种立体结构,如图所示,该结构的二氯代物有______种。
(3)萘也是一种芳香烃,它的分子式是C10H8,请你判断,它的结构简式可能是下列中的______(填字母编号)。
(4)根据第(3)小题中你判断得到的萘结构简式,它不能解释萘的下列事实中的__________(填字母编号)。
A.萘不能使溴的四氯化碳溶液褪色
B.萘能与H2发生加成反应
C.萘分子中所有原子在同一平面上
D.一溴代萘(C10H7Br)只有两种
(5)现代化学认为萘分子碳碳之间的键是____________________________________。
苯的同系物中,有的侧链能被酸性高锰酸钾溶液氧化,生成芳香酸,反应如下: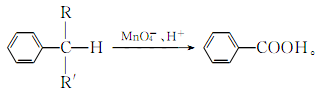
(R、R′表示烷基或氢原子)
(1)现有苯的同系物甲、乙,分子式都是C10H14。甲不能被酸性高锰酸钾溶液氧化为芳香酸,它的结构简式是________;乙能被酸性高锰酸钾溶液氧化为分子式为C8H6O4的芳香酸,则乙可能的结构有________种。
(2)有机物丙也是苯的同系物,分子式也是C10H14,它的苯环上的一溴代物只有一种。试写出丙所有可能的结构简式:_______________________________________________________________________________。
2丁烯是石油裂解的产物之一,回答下列问题:
(1)在催化剂作用下,2丁烯与氢气反应的化学方程式为__________________________________,反应类型为________。
(2)烯烃A是2丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为________________;A分子中能够共平面的碳原子个数为________,A与溴的四氯化碳溶液反应的化学方程式为_______________________________________。
在一定条件下,某些不饱和烃分子可以进行自身加成反应,例如: 。
。
有机物甲的结构简式为 ,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的。在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体。 则乙的结构简式是___________________________________,
,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的。在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体。 则乙的结构简式是___________________________________,
丙的结构简式是____________________________________________________。
1丁炔的最简式是________,它与过量溴加成后产物的结构简式是________;有机物A的分子式与1丁炔相同,而且属于同一类别,A与过量溴加成后产物的结构简式是________;与1丁炔属于同系物且所含碳原子数最少的有机物是________,它能发生________(填反应类型)反应制造导电塑料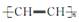 ,这是21世纪具有广阔前景的合成材料。
,这是21世纪具有广阔前景的合成材料。