下列属于放热反应的是
| A.2Na+2H2O═2NaOH+H2↑ |
B.CaCO3 CaO+CO2↑ CaO+CO2↑ |
C.C+H2O CO+H2 CO+H2 |
| D.2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O |
在一定温度下,可逆反应:A2(气)+B2(气) 2AB(气),达到平衡的标志是
2AB(气),达到平衡的标志是
| A.容器的总压强不随时间而变化 |
| B.单位时间内有n molA2生成的同时有n molB2生成 |
| C.单位时间内有n molB2发生反应的同时有n molAB分解 |
| D.单位时间内生成n molA2同时就有2n molAB生成 |
在20mL0.1mol/L 的醋酸溶液中,能使溶液的pH减小,而且使醋酸的电离平衡向逆方向移动,可加入的试剂是
| A.20mL水 | B.浓盐酸 | C.冰醋酸 | D.NaOH溶液 |
关于强弱电解质及非电解质的组合完全正确的是
| A |
B |
C |
D |
|
| 强电解质 |
NaCl |
H2SO4 |
CaCO3 |
HNO3 |
| 弱电解质 |
HF |
BaSO4 |
HClO |
CH3COOH |
| 非电解质 |
Cl2 |
CS2 |
盐酸 |
SO2 |
下列热化学方程式书写正确的是
A.2SO2+O2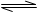 2SO3;ΔH =-196.6kJ/mol 2SO3;ΔH =-196.6kJ/mol |
| B.C(s)+O2(g)=CO2(g);ΔH =393.5kJ/mol |
| C.1/2H2(g)+1/2Cl2(g)=HCl(g);ΔH =-92.5kJ/mol |
| D.H+(aq)+OH-(aq)=H2O(l);ΔH =57.3kJ/mol |
盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)=H2O(l)ΔH1 =-Q1kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2=-Q2kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3 =-Q3kJ/mol
若使0.5mol乙醇液体完全燃烧,最后恢复到室温,则放出的热量为(kJ)
| A.Q1+Q2+Q3 |
| B.0.5(Q1+Q2+Q3) |
| C.0.5 Q2-1.5 Q1-0.5Q3 |
| D.1.5 Q1-0.5 Q2+0.5Q3 |