直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.

(1)101KPa时,1mol气态CH3OH完全燃烧生成CO2气体和液态水时,放出726.51kJ的热量,则甲醇燃烧的热化学方程式是 .
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O (g)═CO2(g)+3H2(g);△H1═+49.0KJ•mol﹣1
②CH3OH(g)+ O2(g)═CO2(g)+2H2(g);△H2═?
O2(g)═CO2(g)+2H2(g);△H2═?
已知H2(g)+ O2(g)═H2O (g)△H═﹣241.8KJ•mol﹣1,则反应②的△H2= .
O2(g)═H2O (g)△H═﹣241.8KJ•mol﹣1,则反应②的△H2= .
(3)一种甲醇燃料电池是采用铂或碳化钨作电极,稀硫酸作电解液,一极直接加入纯化后的甲醇,同时向另一个电极通人空气.则甲醇进入 极,正极发生的电极反应方程式为 .
下图为以惰性电极进行电解。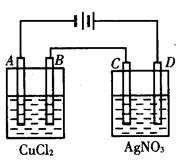
完成下列问题
(1)A电极的现象是B电极的电极反应方程式
D电极的反应方程式
(2)若电路中通过1mol电子,C电极的增重为g
常温下有浓度均为0.05mol/L的四种溶液:①Na2CO3②NaHCO3③HCl ④NH3·H2O,回答相关问题:
(1)上述溶液中,可发生水解的是(填序号)
(2)上述溶液中,既能与NaOH溶液反应,又能与H2SO4溶液反应的溶
液中,离子浓度大小的关系
(3)向④中加入少量NH4Cl固体,此时c(NH4+/OH-)的值(“增大”、“减小”或“不变” )
(4)若将③和④的溶液混合后,溶液恰好呈中性,则混合前③的体积④的体积(“大于”、“小于”或“等于” )
(5)取10mL的③溶液,加水稀释到500mL,则此溶液中由水电离出的c(H+) =mol/L
请完成下列各空:
(1) pH= a的CH3COOH溶液稀释100倍后所得溶液pHa +2(填“>”或“<”下同)
(2)0.1 mol·L-1CH3COONa溶液的pH7
某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
若实验操作、数据记录均是正确的,试分析数据回答下列问题:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为_____mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题。
(1)图中所示的反应是__________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要” )加热,该反应的ΔH=________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ/mol该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为__________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因___________。