下列关于热化学反应的描述中正确的是
| A.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则: 2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1 |
| B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是: CH3OH(g)+  O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1, O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1 |
| C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1 |
| D.葡萄糖的燃烧热是2 800 kJ·mol-1,则 |
 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l)ΔH=-1 400 kJ·mol-1
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是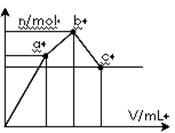
| A.a点的溶液呈中性 |
| B.b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH— ="=" Al(OH)3↓+2BaSO4↓ |
| C.c点加入Ba(OH)2溶液的体积为200 mL |
| D.c点溶液呈碱性 |
有一混合溶液,其中只含有Fe2+、Cl—、Br—、I—(忽略水的电离),其中Cl—、Br—、I—的个数比为2:3:4,向该溶液中通人氯气使溶液中Cl—和Br—的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为
| A.7:2 | B.7:1 | C.7:3 | D.7:4 |
下列离子方程式书写正确的是
| A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性: 2H+ + SO42- + Ba2+ + 2OHOHOHOH- = BaSO4↓+ 2H2O |
| B.将标准状况下112 mL氯气通入10 mL 1 mol·L-1的溴化亚铁溶液中: 2Fe2+ + 4Br-+ 3Cl2 = 2Fe3+ + 6Cl- + 2Br2 |
C.用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
| D.向澄清石灰水中加入过量的碳酸氢钠溶液: Ca2+ + OHOHOHOH- + HCO3-= CaCO3↓ + H2O |
已知在酸性条件下有以下反应关系:
①KBrO3能将I-氧化成KIO3,本身被还原为Br2;
②Br2能将I-氧化为I2;
③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,本身被还原为I2。
向KBrO3溶液中滴加少量KI的硫酸溶液后,所得产物除水外还有
| A.Br-、I2 | B.Br2、IO |
C.Br2、I2、IO |
D.Br2、Br-、I2 |
实验是化学研究的基础。下列关于各实验装置的叙述正确的是
| A.装置③可用于收集H2、CO2、Cl2、NH3等气体 |
| B.装置②可用于吸收NH3或HCl气体,并防止倒吸 |
| C.装置①常用于分离互不相溶的液体混合物 |
| D.装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 |