在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
| A.反应混合物的浓度 | B.反应体系的压强 |
| C.正、逆反应的速率 | D.反应物的转化率 |
下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓HNO3,其中在一定条件下能与SiO2反应的有
| A.①②⑥ | B.全部 | C.①③④⑤ | D.②③⑥ |
设NA表示阿佛加德罗常数,下列说法正确的是
| A.1mol CaC2中有3NA个离子 |
| B.1mol SiO2中含有2NA个共价键 |
| C.1L 1mol/L CH3COONa溶液中含NA个CH3COO—离子 |
| D.42g C2H4和C3H6的混合物中一定含有6NA个氢原子 |
减缓温室气体排放是2009年哥本哈根气候变化会议的议题,下列反应不产生温室气体的是
| A.用纯碱制取玻璃 | B.用煤炭作燃料 |
| C.用氨制取碳酸铵 | D.煅烧石灰石制生石灰 |
以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到4mol Fe(OH)3沉淀,此间共消耗的水的物质的量为
| A.8mol | B.10mol | C.11mol | D.12mol |
20℃时H2S饱溶液1L,其浓度为0.1mol·L-1,其电离方程式为H2S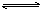 H++HS-,HS-
H++HS-,HS-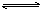 H++S2-,若要使该溶液[H+]及[S2-]都减小,可采取的措施是
H++S2-,若要使该溶液[H+]及[S2-]都减小,可采取的措施是
| A.加入适量的水 | B.加入适量的NaOH固体 |
| C.通入适量的Cl2 | D.加入适量的CuSO4固体 |