在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是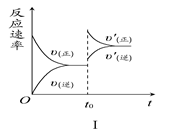

| A.图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响 |
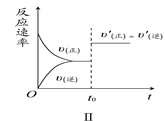
| B.图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响 |
| C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高 |
| D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
NA为阿伏加德罗常数,下述正确的是
| A.58.5g氯化钠晶体中含有NA个氯化钠分子 |
| B.20g重水(D2O)中含有的电子数为10NA |
| C.标准状况下,22.4LCCl4含有NA个CCl4分子 |
| D.120gNaHSO4晶体中阳离子和阴离子的总数为3NA |
在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;若加入足量强碱并加热可得到c mol NH3,则原溶液中的Al3+浓度(mol/L)为
A. |
B. |
C. |
D. |
在酸性高锰酸钾溶液中加入过氧化钠粉末,溶液褪色,其中发生反应的离子方程式为:2MnO4-+16H++5Na2O2===2Mn2++5O2↑+8H2O+10Na+。下列判断正确的是
| A.O2是还原产物,Mn2+是氧化产物 |
| B.Na2O2既是氧化剂,又是还原剂 |
| C.标准状况下,产生22.4 L O2时反应转移2 mol e- |
| D.通常用浓盐酸酸化高锰酸钾溶液 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.无色溶液中: Al3+、Cl—、MnO4—、SO42— |
| B.含有大量Fe3+的溶液中:Na+、Mg2+、NO3—、SCN— |
| C.0.1 mol·L-1AgNO3溶液:H+、K+、SO42—、I— |
| D.使酚酞变红色的溶液:CO32—、Cl—、F—、K+ |
分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是
| A.冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 |
| B.HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 |
| C.漂白粉、福尔马林、冰水、王水、氯水均为混合物 |
| D.Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物 |