根据原子结构与元素周期律的知识,下列推断正确的是
| A.同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B.核外电子排布相同的微粒化学性质也相同 |
| C.Cl﹣、S2-、Ca2+、K+半径逐渐减小 |
| D.1735 Cl 与1737 Cl 得电子能力相同 |
已知热化学方程式:SO2(g)+ O2(g)  SO3(g)△H =" ―98.32" kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
SO3(g)△H =" ―98.32" kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
| A.196.64kJ | B.196.64kJ/mol | C.<196.64kJ | D.>196.64kJ |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.甲烷的燃烧热就是1mol甲烷燃烧生成气态水和二氧化碳所放出的热量 |
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.钢铁的腐蚀过程绝大多数都是电化学腐蚀 |
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
C.电解CuCl2饱和溶液,生成金属铜和氯气 |
D.电解MgCl2饱和溶液,可制得金属镁 |
在体积可变的容器中发生反应N2 + 3H2  NH3当增大压强使
NH3当增大压强使 容器体积缩小时,化学反应速率加快,其主要原因是
容器体积缩小时,化学反应速率加快,其主要原因是
| A.分子运动速率加快,使反应物分子间的碰撞机会增多 |
| B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
C.活化分子百分数未变,但单位体积内活化 分子数增加,有效碰撞次数增多 分子数增加,有效碰撞次数增多 |
| D.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞 |
如图所示,下列叙述正确的是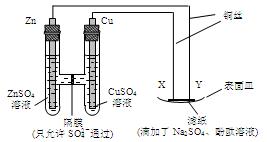
| A.Y为阴极,发生还原反应 |
| B.X为正极,发生氧化反应 |
| C.Y与滤纸接触处有氧气生成 |
| D.X与滤纸接触处变红 |