(18分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,请答题:
(1)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2: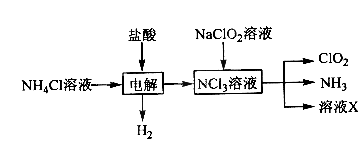
①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有__________。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(2)用下图装置可以测定混合气中ClO2的含量:

Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为 。
②玻璃液封装置的作用是 。
③V中加入的指示剂通常为 ,滴定至终点的现象是 。
④测得混合气中ClO2的质量为 g。(相对原子质量Cl35.5 O16)
(3)用ClO2处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是_______(填标号)。
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
玻璃与人们的生产生活密切联系。玻璃制品随处可见。
(1)一般住宅的窗玻璃是普通玻璃,制造普通玻璃的主要原料________、________、________,粉碎后放入玻璃窑中在高温下发生反应生成玻璃,普通玻璃的主要成分是________、________、________。
(2)某玻璃中含Na2O、CaO、SiO2的质量之比为31∶28∶180,此玻璃的组成为(填选项)________。
A.Na2O·CaO·6H2SiO3B.Na2O·CaO·6SiO2
C.2Na2O·2CaO·9SiO2D.6Na2O·6CaO·SiO2
(3)我们看到的普通玻璃,一般都呈淡绿色,这是因为原料中混有Fe2+的原因。
在制玻璃的原料中,再加入下列物质后,可制得各种不同用途的玻璃。
A.氧化亚铜(Cu2O)
B.氧化钴(Co2O3)
C.氧化铅(PbO)
D.硼砂(Na2B4O7·10H2O)
①制造化学仪器的玻璃需加入的物质是________。
②制造光学仪器的玻璃需加入的物质是________。
③制造蓝色玻璃需加入的物质是________。
④制造红色玻璃需加入的物质是________。
每年世界上钢铁的产量很高,但钢铁腐蚀也给人类带来了巨大的损失,因此如何更好地进行金属防护,一直是科学研究领域中的重要课题。
(1)钢铁在潮湿的空气中的锈蚀主要属于________,沿海地区的钢铁腐蚀比内陆地区更严重的原因是_______________________________________________________。
(2)据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是_____________________________。
(3)在工业上常用亚硫酸钠除去水中溶解的氧,防止输水管被腐蚀,请简要说明原因__________________________________________________________。
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为__________________________。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中
焊接在铁闸门上的固体材料R可以采用 ( )。
| A.铜 | B.钠 | C.锌 | D.石墨 |
(3)图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的________极。
下图中a为生铁,A烧杯中放入苯,B烧杯中为1 mol·L-1的稀硫酸,C烧杯中为海水。
(1)B中Pt极的电极反应式为________。
(2)C中Cu极的电极反应式为________,Cu极附近溶液的pH________(填“增大”、“减小”或“不变”)。
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________。
(4)要使B中的铁难被腐蚀,可将B中的稀硫酸改为________。
写出铁生锈的有关化学方程式,是氧化还原反应的标出电子转移的方向和数目,不是氧化还原反应的说明反应类型。
(1)铁→氢氧化亚铁:______________________________________________。
(2)氢氧化亚铁→氢氧化铁:________________________________________。
(3)氢氧化铁→氧化铁:____________________________________________。