海水开发利用的部分过程如图所示。下列说法错误的是
| A.向苦卤中通入Cl2是为了提取溴 |
| B.粗盐可采用除杂和重结晶等过程提纯 |
| C.工业生产中常选用NaOH作为沉淀剂 |
| D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
根据右图装置判断下列说法错误的是()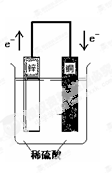
| A.铜片上有大量气泡产生 |
| B.铜片上发生氧化反应 |
| C.锌片为负极 |
| D.该装置将化学能转化为电能 |
设NA表示阿伏加德罗常数,下列叙述中正确的是()
| A.1L1mol·L-1的盐酸溶液中,所含氯化氢分子数为NA |
| B.11.2L氢气中所含有的原子数为NA |
| C.标准状况下,22.4 L水所含分子数为NA |
| D.常温常压下,48gO3和O2的混合气体中氧原子数为3NA |
下列有关物质检验的实验结论正确的是()
| 选项 |
实 验 操 作 及 现 象 |
实 验 结 论 |
| A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
| B |
向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 |
该溶液中一定含有Fe2+ |
| C |
将某气体通入品红溶液中,品红溶液褪色 |
该气体一定是SO2 |
| D |
将某物质的溶液滴加到酚酞试液中,溶液呈红色 |
该物质一定是碱 |
纤维素被称为“第七营养素”,食物中的纤维素虽然不能为人体提供能量,但能促进肠道
蠕动、吸附排出的有害物质。从它的化学成分看,它是一种( )
| A.二糖 | B.多糖 | C.氨基酸 | D.脂肪 |
下列说法,不正确的是
| A.糖类摄入不足,人易患低血糖;而摄入过多,则可能引发动脉硬化、冠心病等疾病 |
| B.某些植物油和鱼油中的不饱和酯含量丰富,而动物脂肪中饱和酯含量较高 |
| C.蛋白质溶液遇到浓的硫酸铵等无机盐溶液,会析出沉淀,这个过程称为“变性” |
| D.人体对维生素的需求量很小,但是,人类的生命活动不可缺少它 |