下面是溶解性表中的部分内容(室温下测定):
| 阳离子 |
阴离子 |
||
| |
OH- |
SO42- |
SO32- |
| Ca2+ |
① |
微 |
不 |
| Fe3+ |
不 |
溶 |
② |
| Cu2+ |
不 |
③ |
不 |
下列有关说法中正确的是
A.①处物质属于可溶性碱
B.②处物质组成为Fe2(SO3)3
C.③处物质为硫酸盐或者铜盐
D.①、③处物质在溶液中发生的反应一定是Cu2++2OH-===Cu(OH)2↓
设NA为阿伏加德罗常数的值,N表示粒子数。下列说法正确的是
| A.0.1 mol苯乙烯中含有碳碳双键的数目为0.4NA |
| B.将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)] |
| C.一定条件下,0.1 mol SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
| D.电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g |
下列图示与对应的叙述相符的是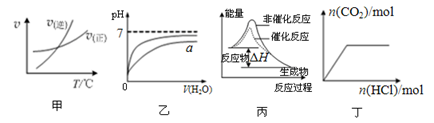
| A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0 |
| B.图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸 |
| C.图丙表示该反应为放热反应,且催化剂能改变反应的焓变 |
| D.图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系 |
如图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0. 2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是:
| A.c(OH-)一定大于c(CH3COO-) | B.c(OH-)一定小于c(CH3COO-) |
| C.c(OH-)一定等于c(CH3COO-) | D.c(OH-)大于、小于或等于c(CH3COO-) |
某有机物X的结构简式如图所示,则下列有关说法中正确的是: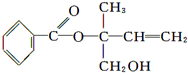
| A.X的分子式为C12H16O3 |
| B.可用酸性高锰酸钾溶液区分苯和X |
| C.X在一定条件下能发生加成、加聚、取代、消去等反应 |
| D.在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成 |
下列叙述正确的是
| A.Na在足量O2中燃烧,消耗lmol O2时转移的电子数是4×6.02×1023 |
| B.盐酸和醋酸的混合溶液pH=1,该溶液中c(H+) =" 0.1" mol/L |
C.1 L 0.1 mol/L NH4Cl溶液中的N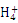 数是0.1×6.02×1023 数是0.1×6.02×1023 |
| D.标准状况下2.24 L Cl2中含有0.2 mol 共价键 |