某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是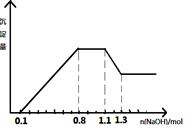
| A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+ |
| B.溶液中一定不含CO32-和NO3-,一定含有SO42- |
| C.溶液中c(NH4+)=0.3 mol/L |
| D.c(H+)∶c (Al3+)∶c(Mg2+)=1∶1∶1 |
已知三角锥型分子E和直线型分子G反应,生成两种直线型分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如图15,则下列判断错误的是()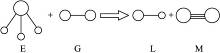
图1-5
| A.G是最活泼的非金属单质 |
| B.L是极性分子 |
| C.E能使紫色石蕊试液变蓝色 |
| D.M化学性质活泼 |
加入氢氧化钡溶液共热,有气体放出又有不溶于稀硝酸的白色沉淀生成的是()
| A.KNO3溶液 |
| B.NH4NO3溶液 |
| C.(NH4)2SO4溶液 |
| D.Na2SO4溶液 |
下列分子中,属于含有极性键的非极性分子的是()
| A.NH3 | B.CO2 | C.NO2 | D.H2O2 |
对于1 mol·L-1的氨水,下列叙述正确的是(忽略溶液混合时的体积变化)()
| A.将标准状况下22.4 L氨气溶于1 L水中配成溶液,即可得1 mol·L-1的氨水 |
| B.1 mol·L-1的氨水的质量分数小于1.7% |
| C.将1 mol·L-1的氨水与水等质量混合后,所得氨水的物质的量浓度大于0.5 mol·L-1 |
| D.将1 mol·L-1的氨水与3 mol·L-1的氨水等质量混合后,所得氨水的物质的量浓度为2 mol·L-1 |
下列物质可用来干燥NH3的是()
| A.浓H2SO4 | B.碱石灰 |
| C.P2O5 | D.无水CaCl2 |