我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O +NaCl NaHCO3↓+NH4Cl ;
2NaHCO3 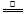 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)NH3、CO2与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3的操作是 (填分离操作的名称)。
②另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:________________。
用98%的浓H2SO4(ρ=1.84g/cm3)配制250ml 0.5mol/L的稀H2SO4的操作简单可概括为计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶。请按要求填空:
(1)所需浓H2SO4的体积为 。
(2)如果实验室有10mL、20mL、50mL量筒,应选用 mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将 (偏高、偏低、无影响)。·
(3)除量筒和胶头滴管外还需用到的玻璃仪器有: 。
(4)洗涤操作一般要求重复 次,且洗涤液均要 。
(5)定容的操作为:向容量瓶中加入蒸馏水,至液面离刻度线 处,改用胶头滴管滴加,至 。
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________,(填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式__________________。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是____________;若蒸发皿质量是w1 g,蒸发皿与加热后固体总质量是w2 g,则样品中铁元素的质量分数是_____。
Ⅱ.有同学提出,还可以采用以下方法来测定:
(1)溶解样品改用了硫酸,而不在用盐酸,为什么?
__________________________。
(2)选择的还原剂是否能用铁__________(填“是”或“否”),原因是:__________。
(3)若滴定用掉c mol/L KMnO4溶液b mL,则样品中铁元素的质量分数是____________。
( 12分)绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体,反应原理为:
(NH4)2SO4+FeSO4+6H2O=(NH4)2SO4•FeSO4•6H2O↓。其流程可表示为: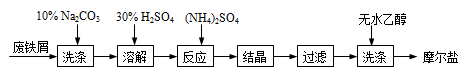
(1)洗涤中Na2CO3的主要作用是 。
(2)结晶过程中要加热蒸发溶剂,浓缩结晶。应加热到 时,停止加热。
(3)过滤是用下图装置进行,这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是 。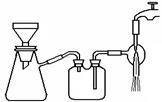
(4)用无水乙醇洗涤的目的是 。
(5)产品中Fe2+的定量分析:制得的摩尔盐样品中往往含
有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含量,
一般采用在酸性条件下KMnO4标准液滴定的方法。称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①本实验的指示剂是 。
| A.酚酞 | B.甲基橙 | C.石蕊 | D.不需要 |
②产品中Fe2+的质量分数为 。
( 19分)CuSO4∙5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4∙5H2O的实验室制备流程圈。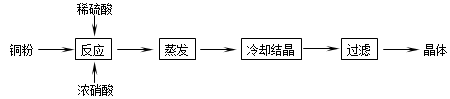
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:
、 。
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4∙5H2O中可能存在的杂质是 ,除去这种杂质的实验操作称为 。
(3)称取0.1000 g提纯后的CuSO4∙5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.1000 g该试样中含CuSO4∙5H2O g。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用 。在滴定中,准确读数应该是视线 。
(5)如果采用重量法测定CuSO4∙5H2O的含量,完成下列步骤:
① ②加水溶解 ②加氯化钡溶液,沉淀 ④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是 。
SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如下:
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡[Sn(OH)Cl]。
(1)写出物质A的名称:________。
(2)SnCl2用盐酸而不用水溶解的原因是____________________(用化学方程式表示)。
(3)锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式:_______________。
(4)反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:____。该反应的温度需要控制在75 ℃左右的原因是____。
(5)实验室中“漂洗”沉淀的实验操作方法是____。