CuSO4是一种重要的化工原料,其有关制备途径及性质如下图所示。下列说法不正确的是
| A.相对于途径①,途径②更好地体现了绿色化学思想 |
| B.Y可以是葡萄糖溶液 |
| C.CuSO4在1100℃分解所得混合气体X一定有O2 |
| D.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:1 |
关于原电池和电解池的叙述正确的是()
| A.原电池中失去电子的电极为阴极 |
| B.原电池的负极、电解池的阳极都发生氧化反应 |
| C.原电池的两极一定是由活动性不同的两种金属组成 |
| D.电解时电解池的阴极一定是阴离子放电 |
已知下列热化学方程式:Zn(s)+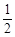 O2(g)=ZnO(s) △H =-351.1kJ·mol-1 ,Hg(l)+
O2(g)=ZnO(s) △H =-351.1kJ·mol-1 ,Hg(l)+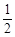 O2(g)=HgO(s) △H =-90.7 kJ·mol-1 由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为( )
O2(g)=HgO(s) △H =-90.7 kJ·mol-1 由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为( )
| A.-260.4 kJ·mol-1 |
| B.-441.8 kJ·mol-1 |
| C.260.4 kJ·mol-1 |
| D.441.8 kJ·mol-1 |
下列说法正确的是( )
| A.1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| B.强酸和强碱的稀溶液发生中和反应一定是放热反应,弱酸和弱碱反应一定也是放热反应 |
| C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应 |
| D.酸和碱发生中和反应生成1 mol 水,这时的反应热叫中和热 |
HA为酸性略强于醋酸的一元弱酸,在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是( )
| A.c(Na+)>c(A-)>c(H+)>c(OH-) | B.c(Na+)>c(OH-)>c(A-)>c(H+) |
| C.c(Na+)+c(OH-)=c(A-)+c(H+) | D.c(Na+)+c(H+)=c(A-)+c(OH-) |
下列实验操作或对实验事实的叙述中存在错误的是 ( )
| A.用50mL酸式滴定管准确量取23.20mL酸性KMnO4溶液,放入锥形瓶中待用 |
| B.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| C.酸碱中和滴定时,锥形瓶未用待装液润洗。 |
| D.用惰性电极电解NaCl溶液,一段时间后,再加盐酸,可使溶液与原溶液完全一样。 |