氧化还原反应在生产、生话中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂。用所学知识回答问题( )
(1)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为 ,反应中消耗1mol的MnO4—时转移电子数为 。
(2)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是 。
现有可逆反应.2NO2(g) N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
t2:;
t3:;
t4:。
现有反应:mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的的转化率_________。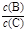 (4)若升高温度,则平衡时B、C的浓度之比将_________。
(4)若升高温度,则平衡时B、C的浓度之比将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量_________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______;而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
(14分,每空2分)已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X 原子的电子层数与它的核外电子总数相同,而Z 原子的最外层电子数是次外层的三倍,Y 与 Z 可以形成两种以上的气态化合物,则
(1)X 是——————————、Y是———————————、Z是———————————(均用元素名称填写)
(2)由Y 和 Z 组成,且Y 和 Z的质量比为7:12的化合物的化学式(分子式)是 _____
(3)由X、Y、Z中的两种元素组成,且与X2Z 分子具有相同电子数的两种离子是 _____————————和 _____—————————(填离子符号)
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4 :2 :3 ,该盐的化学式是 _____——————————————————。—
下表是元素周期表的一部分,回答有关问题。
| ⅠА |
ⅡА |
ⅢА |
ⅣА |
ⅤА |
ⅥА |
ⅦА |
0 |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
11 |
12 |
(1)在这些元素中,最活泼的金属元素是(均用元素名称填写)—、最活泼的非金属元素是、最不活泼的元素是
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是(均用化学式填写)、碱性最强的是,呈两性的氢氧化物是,写出三者之间两两相互反应的离子方程式
(3)在这些元素中,原子半径最大的是—、原子半径最小的是(均用元素符号填写)
(4)写出②与④形成化合物的电子式;写出①单质的电子式;
前20号元素A、B、C、D,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1) B元素的原子结构示意图;
(2)C在周期表中的位置;
(3)化合物D2C的电子式__;
(4) B的氢化物的水溶液加入B的最高价氧化物对应水化物的稀溶液,反应的离子方程式为:;
(5)有人认为,A单质是一种优质能源,你认为它作为能源的优点是: