下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中K+、Fe2+、SCN-、Br-可以大量存在 |
| B.和KI溶液反应的离子方程式: Fe3++2I-=Fe2++I2 |
| C.和Ba(OH)2溶液反应离子方程式:Fe3++ SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ |
| D.1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe |
下列各组物质中,不管它们以何种比例混合,只要总物质的量一定,充分燃烧后消耗氧气的量一定的是
| A.C2H2和C6H6 | B.C2H6O和C3H6O2 | C.CH2O和C2H4O2 | D.C3H8和C4H8O2 |
为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
| A.取少量样品放入试管中,加热,试管口放一团蘸有无水硫酸铜粉末的棉花团,变蓝则可证明晶体的成分中含有结晶水 |
| B.取少量样品溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ |
| C.取少量样品溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D.取少量样品放入试管中,加入少量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中是否含有NH4+ |
有机物A的分子式为C6H12O2,在一定条件下发生如下转化关系,且D和E都不能发生银镜反应,由此推断A的可能结构有: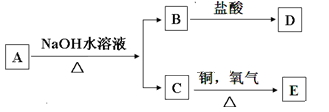
| A.6种 | B.4种 | C.3种 | D.2种 |
下列各组顺序的排列不正确的是
| A.原子半径:Na>Mg>Al | B.热稳定性:HCl> H2S>PH3 |
| C.还原性:I–<Br–<Cl– | D.熔点:金刚石>食盐>干冰 |
下列实验能达到目的的是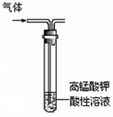
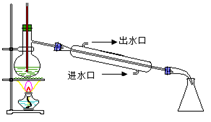

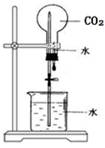
| A.除去乙烷中混有的乙烯 | B.石油蒸馏 | C.乙醇催化氧化 | D.CO2喷泉实验 |