下列叙述正确的是
| A.将5.85 g NaCl晶体溶入100 mL水中,制得0.1 mol/L NaCl溶液 |
| B.将1体积c mol/L硫酸溶液用水稀释为5体积,得到0.2c mol/L硫酸溶液 |
| C.将25 g无水CuSO4溶于水制成100 mL溶液,其浓度为1 mol/L |
| D.将w g a% NaCl溶液蒸发掉w/2 g水,得到4a%NaCl溶液 |
将铁和氧化铁的混合物15g,加入150mL稀硫酸中,在标准状况下放出氢气1.68L,同时铁和氧化铁均无剩余。向溶液中滴入硫氰化钾溶液,未见颜色变化。为了中和过量的硫酸,而且使铁完全转化成Fe(OH)2,共消耗3mol·L-1的氢氧化钠溶液200mL,原硫酸溶液的浓度是
| A.1.5mol·L-1 | B.2mol·L-1 |
| C.2.5mol·L-1 | D.3mol·L-1 |
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果.下列表达正确的是
A.Fe在Cl2中的燃烧产物: |
B.Na与O2反应的产物: |
C.AlCl3溶液中滴加氨水后铝的存在形式: |
D.NaAlO2溶液中滴加盐酸后铝的存在形式: |
如右图所示,6个编号分别表示六种物质:Al、Fe2O3、NaOH溶液、氢碘酸、NH3、O2.凡是直线相连的两种物质均能发生化学反应(已知高温时氨气能还原Fe2O3).图中①表示的物质是
| A.Al | B.NaOH溶液 | C.氢碘酸 | D.O2或Fe2O3 |
中学化学常见物质甲、乙、丙、丁之间存在转化关系:甲+乙→丙+丁。下列说法正确的是()
| A.若甲为铜,丁为氯化亚铁,则乙一定是氯化铁 |
| B.若甲为碳,丁为硅,则丙一定是二氧化碳 |
| C.若甲为铝,丁为铁,则乙一定是氧化铁 |
| D.若甲为镁,丁为氢气,则乙一定是酸 |
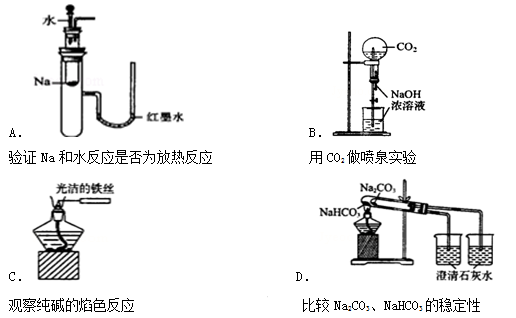
下列实验装置不能达到实验目的是