①CaCO3(s)===CaO(s)+CO2(g) ΔH=-177.7 kJ/mol
②0.5H2SO4(l)+NaOH(l)==0.5Na2SO4(l)+H2O(l) ΔH=-57.3 kJ/mol
③C(s)+O2(g)===CO2(g)ΔH=-393.5 kJ/mol
④CO(g)+1/2O2(g)===CO2(g)ΔH=-283 kJ/mol
⑤HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l)ΔH=-57.3 kJ/mol
(1)上述热化学方程式中,不正确的有_____________ (填序号,以下同) 。
(2)上述反应中,表示燃烧热的热化学方程式是______________;上述反应中,表示中和热的热化学方程式是_________________。
已知:
(1)傅瑞德尔一克拉福茨反应是在苯环上引入烷基的反应: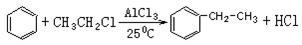
(2)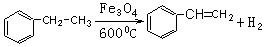
(3)烯烃与HX(X为原子或原子团)加成时,氢原子总是加在含氢较多的不饱和碳上,
即: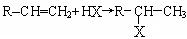
某同学给出了以乙烯、苯、食盐、水等为原料合成 的部分流程图:
的部分流程图:
试回答下列问题:
(1)反应物A可由食盐、水经一系列反应获得,则反应物A为(填化学式),写出制备A 的化学方程式
(2)反应物B为(填化学式)
(3)反应Ⅰ~ Ⅳ中,属于加成反应的是(填序号)
(4)中间产物C的属于芳香烃的同分异构体有种(不包括自身),其中苯环上的一氯代物有2种的是(写结构简式)
(5)下列关于中间产物D的说法不正确的是
| A.既能使酸性高锰酸钾溶液褪色,也能使溴水褪色 |
| B.既能溶于水,也能溶于苯中 |
| C.1mol 中间产物D最多可与4mol H2完全反应 |
| D.所有原子不可能共平面 |
我国著名化学家傅鹰告诫我们“化学给人以知识,化学史给人以智慧。”回顾苯的结构的探索历程,曾有人提出两种立体结构: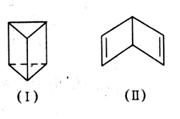

就上述两种立体结构回答下列有关问题:
(1)若苯的结构为(Ⅰ),则在下列项目中它与苯的凯库勒式结构不同的是__________
A.一氯代物种数 B.二氯代物种数
C.与溴水的作用 D.燃烧时烟的浓度
(2)若苯的结构为(Ⅰ),则能解释下列说法中的
A.不能使酸性高锰酸钾溶液褪色 B.苯的邻位二氯代物没有同分异构体
C.在一定条件下能和氢气发生加成反应 D.和氯气在一定条件下发生取代反应
(3)若苯的结构为(Ⅱ),则苯(填“能”或“不能”)使溴水反应褪色?若能,请写
出一个可能反应的化学方程式;若认为不能,请说明原因。
丁基橡胶可用于制造汽车内胎,合成丁基橡胶的一种单体A的分子式为C4H8,A氢化(与H2加成)后得到2—甲基丙烷。完成下列填空:
(1)A的结构简式为
(2)A可以聚合,写出A的两种聚合方式(以反应方程式表示)
(3)将A通入溴的四氯化碳溶液后的现象,原因
(用方程式表示)
(4)A与某烷发生烷基化反应生成分子式为C8H18的物质B,B的一卤代物只有4种,
且碳链不对称。写出B的结构简式:
(5)在一定条件(与NBS作用)下,烯烃中与双键碳相邻碳原子上的一个氢原子可被溴原子取代。则分子式为C4H8的烯烃在一定条件(与NBS作用)下,得到的一溴代烯烃有种
有A、B、C、D、E、F六种短周期元素,原子序数依次增大,B、C、D的阳离子、A的阴离子均具有与氖原子相同的电子层结构;A、B可形成离子化合物B2A;D的最高价氧化物既能与强酸反应,又能与强碱反应;E的原子结构示意图为: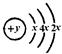 ;F的最外层电子数是电子层数的2倍。WWW.K**S*858$$U.COM
;F的最外层电子数是电子层数的2倍。WWW.K**S*858$$U.COM
试回答下列各问题:
(1)B元素为(填元素符号)
(2)F元素位于元素周期表中第周期第族
(3)化合物B2A的电子式____________________
(4)D的最高价氧化物与B的最高价氧化物对应的水化物溶液反应的离子方程式:
(5)将C、D用导线相连浸入B的最高价氧化物对应的水化物的溶液中,形成原电池,正极的电极反应为
(4分)
(1)用系统命名法给下列物质命名 名称:
名称:
(2)下式是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”
doggycene的分子式为