常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a
B.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是 c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
C.将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-)
D.①Na2CO3溶液②CH3COONa溶液③NaOH溶液,若3种溶液pH均为9,则它们物质的量浓度大小顺序是①>②>③
如图所示,锥形瓶内盛有干燥的气体X,胶头滴管内盛有液体Y ,若挤压胶头滴管,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起。则气体X和液体Y不可能的是
,若挤压胶头滴管,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起。则气体X和液体Y不可能的是
| A.X是Cl2,Y是NaOH溶液 |
| B.X是HCl,Y是NaCl的稀溶液 |
| C.X是SO2,Y是NaOH溶液 |
| D.X是CO2,Y是稀硫酸 |
NA表示阿伏加德罗常数,下列说法正确的是
| A.1 mol Na与足量O2反应生成Na2O或Na2O2均失去2NA个电子 |
| B.1 mol Al分别放入足量冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA个 |
| C.常温常压下,8 g CH4含有的分子数为0.5 NA |
| D.标准状况下,11.2 L H2O含有的分子数为0.5 NA |
下列气体中既不能用浓硫酸干燥,又不能用固体NaOH干燥的是
| A.Cl2 | B.O2 | C.SO2 | D.H2S |
如果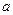 g某气体中含有的分子数为
g某气体中含有的分子数为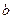 ,则
,则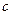 g该气体在标准状
g该气体在标准状 况下占有的体积应表示为(式中
况下占有的体积应表示为(式中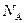 为阿伏加德罗常数的数值)
为阿伏加德罗常数的数值)
A.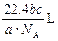 |
B.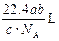 |
C.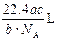 |
D.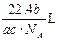 |
有两种金属组成的混合物粉末10g与足量的稀盐酸反应,生成11.2L(标况)H2,则该混合物的组成不可能是
| A.Fe、Zn | B.Al、Cu | C.Al、Mg | D.Al、Fe |