今有如下三个热化学方程式:
H2(g)+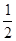 O 2(g)=H2O(g) ΔH=a kJ·mol-1;
O 2(g)=H2O(g) ΔH=a kJ·mol-1;
H2(g)+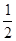 O 2(g)=H2O(l) ΔH=b kJ·mol-1;
O 2(g)=H2O(l) ΔH=b kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) ΔH=c kJ·mol-1。
关于它们的下列表述正确的是
| A.三个都是吸热反应 | B.a、b、c均为正值 |
| C.a=b | D.2b=c |
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
| A.7.8 g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA |
| B.标准状况下,a L的氧气和氮气的混合物含有的分子数为(a/11.2)NA |
| C.60 g SiO2晶体中含有2NA个Si—O键 |
| D.标准状况下,11.2 L乙醇完全燃烧产生的CO2的分子数为0.5NA |
下列有关物质的性质或应用的说法中正确的是( )
| A.Si是一种非金属主族元素,其氧化物可用于制作计算机芯片 |
| B.石油的催化裂化及裂解可以得到较多的轻质油和气态烯烃 |
| C.Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 |
| D.蛋白质溶液中加入浓的硫酸钠溶液,有沉淀析出,这种作用称为变性 |
下列有关化学用语表示正确的是( )
A.比例模型 可以表示二氧化硫分子,也可以表示二氧化碳分子 可以表示二氧化硫分子,也可以表示二氧化碳分子 |
B.电子式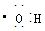 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
C.离子结构示意图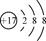 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
| D.结构简式(CH3)2CHOH可以表示1丙醇,也可以表示2丙醇 |
实验室用Zn和盐酸制备H2,将m1 g锌加入到m2 g 20%的盐酸中去,反应结果共放出nL氢气(标准状况),则被还原的HCl的物质的量一定是
| A.0.2m2/36.5 mol | B.m1/36.5 mol | C.m2/36.5 mol | D.n/11.2 mol |
如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O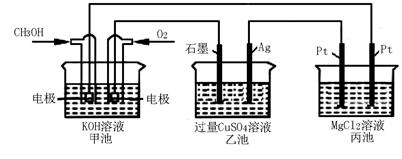
则下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.反应一段时间,向乙池加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |