80℃时,2L密闭容器中充入0.40molN2O4,发生反应N2O4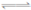 2NO2 △H=+QkJ·mol-1(Q>0) ,获得如下数据:
2NO2 △H=+QkJ·mol-1(Q>0) ,获得如下数据:
| 时间/s |
0 |
20 |
40 |
60 |
80 |
100 |
| c(NO2)/mol·L-1 |
0.00 |
0.12 |
0.20 |
0.26 |
0.30 |
0.30 |
下列判断正确的是
A.升高温度该反应的平衡常数K减小
B.20~40s内,v(N2O4)=0.004mol/(L·s)
C.反应达平衡时,吸收的热量为0.30QkJ
D.100s时再通入0.40molN2O4,达新平衡时N2O4的转化率增大
关于铅蓄电池的说法正确的是( )
| A.充电时,阳极发生的反应是PbSO4(s)+2e-===Pb(s)+SO42-(aq) |
| B.充电时,电池中硫酸的浓度不断变小 |
| C.放电时该电池的负极材料是铅板 |
| D.放电时正极发生的反应是:Pb(s)+SO42-(aq)-2e-===PbSO4(s) |
图Ⅰ是NO2(g)+CO(g) CO2(g)+NO(g)反应过程中能量变化示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ;
CO2(g)+NO(g)反应过程中能量变化示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ;
下列有关说法正确的是( )
| A.该反应的焓变ΔH=+234 kJ·mol-1 |
| B.若X表示体系的压强,则Y表示的可能是NO2的转化率 |
| C.若X表示温度则Y表示的可能是CO2物质的量浓度 |
| D.增大CO的起始浓度,平衡向正反应方向移动,反应热增大 |
一定量的气体在密闭容器中发生反应:xA(g)+yB(g) zC(g),平衡时测得A的浓度为1.0 mol/L,保持温度不变,将容器的容积扩大到原来的2倍,达到新平衡后,测得A的浓度降低为0.60 mol/L。下列有关判断正确的是( )
zC(g),平衡时测得A的浓度为1.0 mol/L,保持温度不变,将容器的容积扩大到原来的2倍,达到新平衡后,测得A的浓度降低为0.60 mol/L。下列有关判断正确的是( )
| A.平衡向正反应方向移动 |
| B.物质B的转化率降低 |
| C.x+y<z |
| D.物质C的体积分数增大 |
下列叙述正确的是( )
| A.95 ℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.pH=3的醋酸溶液,稀释10倍后pH=4 |
| C.0.2 mol·L-1的盐酸,与等体积水混合后pH=1 |
| D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水(l)和二氧化碳。该电池负极发生的反应是( )
| A.CH3OH(g)+O2(g)-2e-===H2O(l)+CO2(g)+2H+(aq) |
| B.O2(g)+4H+(aq)+4e-===2H2O(l) |
| C.CH3OH(g)+H2O(l)-6e-===CO2(g)+6H+(aq) |
| D.O2(g)+2H2O(l)+4e-===4OH-(aq) |