对可逆反应N2(g)+3H2(g) 2NH3(g),△H=-92.4 kJ.mol-1下列叙述正确的是
2NH3(g),△H=-92.4 kJ.mol-1下列叙述正确的是
| A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大 |
| B.若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态 |
| C.若达到平衡时,共放出46.2kJ热量,则有l mo1NH3(g)生成 |
| D.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍 |
1999年4月,发生在比利时的“二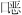 英”污染,极大地影响了该国的食品出口量。“二
英”污染,极大地影响了该国的食品出口量。“二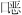 英”是两大类芳香族化合物的总称,其中四氯代二苯并二
英”是两大类芳香族化合物的总称,其中四氯代二苯并二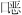 英毒性最大。四氯代二苯并二
英毒性最大。四氯代二苯并二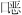 英的结构简式为
英的结构简式为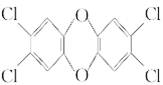 ,有关该化合物的说法不正确的是( )
,有关该化合物的说法不正确的是( )
| A.分子式为C12H8O2Cl4 | B.分子中所有原子都可能处于同一平面 |
| C.是一种难溶于水的物质 | D.可以发生取代反应 |
下列有关胶体和溶液的比较中正确的是 ( )
| A.溶液呈电中性,胶体带有电荷 |
| B.溶液中溶质粒子运动有规律,胶体粒子运动无规律 |
| C.溶液中通过光束没有特殊现象,胶体中通过光束有丁达尔现象 |
| D.通电后,溶液中溶质粒子分别向两极移动,而胶体中分散质粒子向某一极移动 |
下列说法不正确的是( )
| A.磷酸的摩尔质量与NA个磷酸分子的质量在数值上相等 |
| B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1 |
| C.32 g氧气所含的原子数目约为2×6.02×1023 |
| D.常温常压下,0.5 ×6.02 ×1023个一氧化碳分子所占体积是11.2 L |
质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水。得到溶液每毫升的质量为qg,物质的量浓度为c。则溶质的相对分子质量为( )
A. |
B.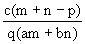 |
C.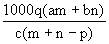 |
D.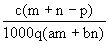 |
下列各组中,两种气体的分子数一定相等的是 。
| A.温度相同、体积相同的O2和N2 |
| B.质量相等、密度不等的N2和C2H4 |
| C.体积相等、密度相等的CO和C2H4 |
| D.压力相等、体积相同的N2和O2 |