在恒容密闭容器中进行N2+3H2 2NH3反应,起始时N2和H2分别为10 mol 和30 mol,当达到平衡时,N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是
2NH3反应,起始时N2和H2分别为10 mol 和30 mol,当达到平衡时,N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是
| A.40 mol 35% | B.20 mol 30% |
| C.20 mol 70% | D.10 mol 50% |
下列对一些实验事实的理论解释正确的是
| 选项 |
实验事实 |
理论解释 |
| A |
氮原子的第一电离能大于氧原子 |
氮原子2p能级半充满 |
| B |
CO2为直线形分子 |
CO2分子中C—O是极性键 |
| C |
金刚石的熔点低于石墨 |
金刚石是分子晶体,石墨是原子晶体 |
| D |
HF的沸点高于HCl |
HF的相对分子质量小于HCl |
下列过程中化学键被破坏的是
①碘升华②溴蒸气被木炭吸附③酒精溶于水④HCl气体溶于水⑤MgCl2溶解于水 ⑥NaCl熔化
| A.全部 | B.②③④⑤⑥ | C.④⑤⑥ | D.⑤⑥ |
关于化学式[TiCl(H2O)5]Cl2·H2O的配合物的下列说法中正确的是
| A.配位体是Cl-和H2O,配位数是9 |
| B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ |
| C.内界和外界中的Cl-的数目比是1:2 |
| D.加入足量AgNO3溶液,所有Cl-均被完全沉淀 |
2008年秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺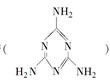 。下列关于三聚氰胺分子的说法正确的是
。下列关于三聚氰胺分子的说法正确的是
| A.所有碳原子采用sp3杂化,所有氮原子采用sp3杂化 |
| B.一个分子中共含有15个σ键 |
| C.属于极性分子,故极易溶于水 |
| D.分子内既有极性键又有非极性键 |
下列判断正确的是
| A.根据同周期元素的第一电离能变化趋势,推出P的第一电离能比S大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7 |
| C.晶体中一定存在化学键 |
| D.正四面体分子中键角只能是109°28′ |