苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g) C6H5CH=CH2(g)+H2 (g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),下图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系。下列说法正确的是
C6H5CH=CH2(g)+H2 (g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),下图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系。下列说法正确的是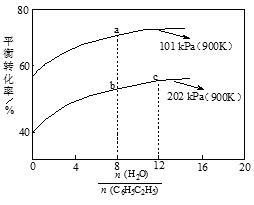
| A.a、b两点转化率不等,但是化学平衡常数相等 |
| B.b点转化率为50%,则混合气体中苯乙烯的体积分数为1/3 |
| C.恒容时加入稀释剂(水蒸气)能减小C6H5C2H5平衡转化率 |
| D.b点和c点温度和压强相同,故其反应速率也相等 |
下列离子方程式中,正确的是高
A.水玻璃中通入足量的CO2: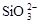 +2CO2+2H2O==H2SiO3 (胶体)+2CO +2CO2+2H2O==H2SiO3 (胶体)+2CO |
| B.氯化亚铁溶液中通入足量的Cl2:2Fe2++Cl2==2Fe3++2Cl- |
C.NaHCO3溶液中加入足量NaHSO4溶液: 2H++CO ==CO2↑+H2O ==CO2↑+H2O |
| D.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
11P + 15CuSO4 + 24H2O = 5Cu3P + 6H3PO4 + 15H2SO4 反应中,被氧化的P原子与被还原的P原子个数比是
| A.6:5 | B.5:6 | C.11:5 | D.11:6 |
20℃时,饱和KCl溶液的密度为1.174g·cm-3,物质的量浓度为4.0mol·L-1,则下列说法中正确的是
| A.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g·cm-3 |
B.此溶液中KCl的质量分数为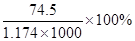 |
| C.密度大于1.174 g·cm-3的KCl溶液是过饱和溶液 |
| D.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1科网 |
下列除杂质(括号中物质为杂质)所用试剂或方法不正确的是
| A.CO2(CO):O2 |
| B.MgO (Al2O3):NaOH溶液 |
| C.NaHCO3溶液(Na2CO3):过量的CO2 |
| D.CO2(HCl):饱和NaHCO3溶液 |
下列替代过程合理的是
| A.医院用BaCO3代替BaSO4作“钡餐” |
| B.家庭用食用醋代替CO2来增强漂白粉的漂白性 |
| C.工业上用电解AlCl3代替Al2O3来冶炼铝 |
| D.实验室用Ca(OH)2溶液代替CaCl2溶液来鉴别Na2CO3和NaHCO3 |