下列离子方程式正确的是
| A.过量氯气通入溴化亚铁溶液中2Fe2++2Br-+2Cl2====Fe3++Br2+4Cl- |
| B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O |
| C.碳酸氢钙和过量的氢氧化钠溶液反应:Ca2++ OH—+HCO3—=CaCO3↓+ H2O |
| D.用FeCl3溶液腐蚀印刷电路板:Cu+Fe3+=Fe2++Cu2+ |
下列物质的类别与所含官能团都正确的是()
A. 酚类 –OH 酚类 –OH |
B.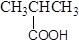 羧酸 –CHO 羧酸 –CHO |
C. 醛类 –CHO 醛类 –CHO |
D.CH3-O-CH3醚类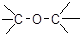 |
为了减少大气污染,许多城市推广清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气。这两类燃料的主要成分是()
| A.碳水化合物 | B.碳氢化合物 | C.氢气 | D.醇类 |
下列各组物质在反应时,由于条件不同,可得到不同产物的是( )
| A.乙醇与钠 | B.水与钠 | C.乙醇与氧气 | D.乙烯与溴水 |
下列分子式不只表示一种物质的是()
| A.C2H6 | B.C3H8 | C.CF2Cl2 | D.C2F2Cl4 |
乙烷和氯气发生取代反应生成二氯乙烷的同分异构体的数目有( )
| A.2种 | B.3种 | C.4种 | D.5种 |