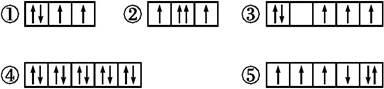
(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,违反了泡利原理的是 ,违反了洪特规则的是 。
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为 ;其最高价氧化物对应水化物的化学式是 。
(3)用符号“>”“<”或“=”表示下列各项关系。
①第一电离能:Na Mg, Mg Ca。
②电负性:O F, F Cl。
③能量高低:ns (n+1)s, ns np。
④主族序数 价电子数 元素最高正化合价。
(7分)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
(1)该反应的化学方程式为:;
(2)反应开始至2min末,X的反应速率为(mol·L-1·min-1);
(3)3min后图中曲线所表示的含义是:。
短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
(1)A的元素符号;D元素在第周期族
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是。(写具体的离子符号)
(3)A、B两元素形成的含有非极性键的化合物的化学式为,它属于(“离子”或“共价”)化合物。
(12分)乙偶姻(F)是一种重要的香料,存在于啤酒中,是酒类调香中一个极其重要的品种。某人工合成乙偶姻的路线如下:
已知: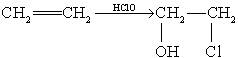
请回答下列问题:
(1)烷烃A只有2种同分异构体(包括A),则A的分子式是
(2)B和G均为一氯代烃,B发生消去反应时,有C和C′两种有机产物,而G发生消去反应时,只有一种有机产物C′。则C和C′的名称(系统命名)分别为,
(3)反应D→E的化学方程式为
(4) 乙偶姻F的结构简式为
(5)任意写出2种能发生水解反应的乙偶姻的同分异构体的结构简式:
工业上由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
(1)聚合物F的结构简式是
(2)C与新制的Cu(OH)2共热转化为D的化学方程式是:
(3)D转化为E的化学方程式是
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是
四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如图所示:
(1)1molA最多可与mol NaOH反应。
(2)A不具有的性质是(填写序号)。
①与FeCl3溶液发生显色反应②加聚反应
③与溴水发生取代反应④与碳酸氢钠溶液反应生成二氧化碳
⑤与溴水发生加成反应
(3)有机化合物B在浓硫酸催化条件下加热发生酯化反应可得到A。请写出B的结构简式
(4)有机化合物C是合成治疗禽流感药物的原料之一,C可以看成是B与氢气按物质的量之比
1:2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能与溴水反应使溴水褪色。请写出C与溴水反应的化学方程式: