将一小块铝片加人某盐酸溶液中,铝片完全溶解,在所得溶液中继续滴加NaOH溶液。生成Al(OH)3的量与加人的NaOH溶液体积的变化关系如图所示,下列说法正确的是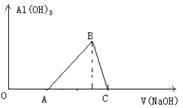
| A.盐酸与铝片反应后,盐酸还有剩余 |
B.图中B点之前发生的离子反应为 |
| C.A→B段消耗的NaOH体积与B→C段消耗的Na 0 H体积比≥3:1 |
| D.溶解铝片的盐酸浓度与滴加的NaOH溶液浓度相等 |
一定温度下,向aL体积固定的密闭容器中加入2molN2(g)、1moH2(g),发生如下反应:N2(g)+3H2(g) 3NH3(g),此反应达到平衡状态的标志是
3NH3(g),此反应达到平衡状态的标志是
| A.相同时间内消耗n mol N2的同时消耗3n mol H2 |
| B.H2的体积分数不再发生变化 |
| C.容器内原子总数不再发生变化 |
| D.容器内气体的密度不再发生变化 |
下列说法正确的是
| A.活化分子碰撞即发生有效碰撞 |
| B.升高温度会加快反应速率,原因是增加了活化分子的碰撞次数 |
| C.某一反应的活化分子百分数是个定值 |
| D.活化分子的碰撞不一定是有效碰撞 |
向含SO42-、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是( )
为了比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:
| 方案 |
现象或产物 |
| ①将铁片置于CuSO4溶液中 |
铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气中燃烧 |
产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别放入热浓硫酸中 |
产物分别为Fe2(SO4)3和CuSO4 |
| ④将铁片和铜片分别放入稀硫酸中 |
铁片上有气泡,铜片上不产生气泡 |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 |
铁片溶解,铜片有气泡产生 |
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有 ( )
A.2种B.3种
C.4种D.5种
①1 L 0.1 mol/L的Na2CO3溶液中逐滴加入240 mL 0.5 mol/L的盐酸;②在240 mL 0.5 mol/L的盐酸中逐滴加入1 L 0.1 mol/L的Na2CO3溶液。两种实验操作在相同状态下产生CO2气体的体积( )
| A.相等 | B.前者多 | C.后者多 | D.无法判断 |