某无色溶液中可能含有Na+、K+、I-、Cu2+、CO32-、SO42-等离子中的全部或其中的几种。现进行以下操作:
①用洁净的铂丝蘸取溶液在无色火焰上灼烧,火焰呈黄色;
②把溶液分成2份,向一份溶液中加入淀粉溶液,再通入氯气,溶液呈蓝色;
③向另一份溶液中加入过量稀硫酸后,产生无色气体,再加氯化钡溶液后,产生白色沉淀。
填写下列空白:
(1)原混合溶液中一定存在的离子是______________,一定不存在的离子是_________。
(2)上述①~③操作中,_______是错误的,应改为加过量的_________,以便确定_______离子是否存在。
(3)为确定原溶液中_________离子是否存在,应补充的操作是_____________。
求下列混合后溶液的pH:(lg2=0.3 lg5=0.7)
(1)把pH=2和pH=4的两种强酸溶液等体积混合,其pH=_______。
(2)把pH=12和pH=14的两种强碱溶液等体积混合,其pH=_________。
(3)把pH=2的H2SO4溶液和pH=10的NaOH溶液等体积混合,其pH=_______。
按要求完成下列化学反应式
(1)硫酸氢钠在水溶液中的电离方程式 ;
(2)Na2CO3溶液水解的离子方程式 ;
(3)Al2(SO4)3溶液与NaHCO3溶液混合反应的离子方程式 ;
(4)Mg3N2与水反应的化学方程式 ;
将一定质量的Mg和Al的混合物投入2.0 mol/L,250 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。回答下列问题:
(1)由图可知加入镁的物质的量是 _____________________。
(2)当加入NaOH溶液的体积小于20mL时发生的离子反应是__________,当加入NaOH溶液的体积大于200 mL时发生的离子反应是______________。
(3)NaOH溶液的物质的量浓度为______________________。
如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题: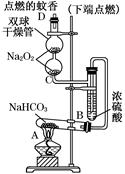
(1)在A试管内发生反应的化学方程式是___________________。
(2)B装置的作用是__________________________________。
(3)在双球干燥管内发生反应的化学方程式为_______________。
(4)双球干燥管内观察到的实验现象是__________________________
____________________________________________________________________。
上述实验现象说明________________________________________________________。
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是_________。
Ⅰ、物质的分离和提纯有多种方法。物质分离、提纯方案的设计在科学研究和工业生产中占有十分重要的地位。工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、SiO2等,已知SiO2是不溶于水的酸性氧化物,Fe2O3是不溶于水的碱性氧化物)。某研究小组设计的提纯Al2O3的方案如下:
(1)写出沉淀A的化学式:___________________________________________________。
(2)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________________________。
(3)写出由沉淀A—→Al2O3的化学方程式:________________________,通入过量CO2生成沉淀A时反应的离子方程式为_______________________________________________。
Ⅱ、按照要求回答下列问题:
A、B、C、D、E是常见化合物或单质,有如下转化关系 (略去条件和副产品)。
(1)若A为黄绿色气体单质,D、E为生活中常见的两种金属,其中E是一种红色光亮的物质。
① 写出向B的溶液中加入足量D的离子反应方程式_____________________________________。
②向①所得的溶液中加入NaOH溶液,并在空气中放置的现象是:_________________________,写出固体在空气中放置的化学反应方程式:__________________________________________。