氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物。
(1)OF2是一种棕黄色有恶臭的气体,有极强的氧化性。
①OF2中氧元素的化合价为 。
②将Fz通入稀的NaOH溶液中可得到OF2、盐等物质,相应反应的化学方程式为____。
(2)过氧化氢是一种绿色氧化剂、还原剂,工业上有多种方法制备H2O2。
①研究表明,H2O2相当于二元弱酸,则它的一级电离方程式为 ,已知常温下1L的H2O2相当于48.3 mol,其K1≈1.67×10 -12.则该温度下H2O2中c(H+)约为 ,写出它与足量Ba(OH)2反应的化学方程式为 。
②乙基蒽醌法是制备过氧化氢最常用的方法,其主要过程可以用下图表示,写出此过程的总反应方程式
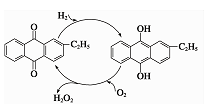
③空气阴极法制备H2O2是一种环境友好型、节能型制备方法,电解总方程式 ,
,
则阳极上电极反应式为 。
(3)氧也能与钾元素形成K2O、K2O2、KO2、KO3等氧化物,其中KO2是一种比Na2O2效率高的供氧剂,写出它与CO2反应的化学方程式 。
下列五个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量,从A——E中选择各题要求的序号填入表中
| 溶液 |
加入的物质 |
答案序号 |
| 饱和石灰水 |
通CO2至过量 |
|
| AlCl3溶液 |
通入过量的NH3 |
|
| 含少量NaOH的NaAlO2溶液 |
通入过量的CO2 |
|
| NaAlO2溶液 |
滴加稀HCl至过量 |
|
| MgCl2、AlCl3的混合液 |
滴加NaOH至过量 |
我国化学家侯德榜(下图所示)改革国外的纯碱生产工艺,生产流程可简要表示如下: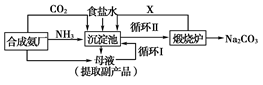

(1)上述生产纯碱的方法称__________________,副产品的一种用途为_______
_。
(2)沉淀池中发生的化学反应方程式是____________________。
(3)写出上述流程中X物质的分子式________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了____(填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加_______________。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用有______。
a.增大NH的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
欲除去下列物质中的少量杂质,请填写所用方法及反应的化学方程式。
| 欲除去的少量杂质 |
方法 |
反应的化学方程式 |
| (1)Na2CO3固体中的NaHCO3 |
||
| (2)NaCl溶液中的Na2CO3 |
||
| (3)NaOH溶液中的Na2CO3 |
某固体混合物可能由KNO3、KI、NaCl、CuCl2中的一种或几种组成,依次进行下列实验,观察到的现象记录如下:①混合物加水得无色透明溶液②将一份溶液滴加氯水并加入CCl4,振荡后静置,CCl4层呈紫色③将另一份溶液加入硝酸银溶液,有白色沉淀生成,该沉淀不溶于稀硝酸。
(1)混合物中肯定含有(),但不能判断出是否含有()。
(2)②中反应的离子方程式为。
(3)③中反应的离子方程式为。
某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图为。