某中学有甲、乙两个探究性学习小组,他们拟用小颗粒状铝硅合金与足量稀硫酸的反应测定通常状况(约20 ℃,1 atm)下气体摩尔体积。
(1)甲组同学拟选用下列实验装置完成实验:
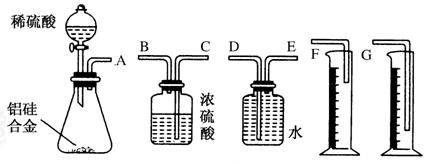
①该组同学必须选用的装置的连接顺序是A接( )、( )接( )、( )接( )(填接口字母,可不填满);
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸不能顺利滴入锥形瓶。请你帮助分析原因_________;
③实验结束时,该组同学应怎样测量实验中生成氢气的体积?__________。
(2)乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如下图所示的实验装置。
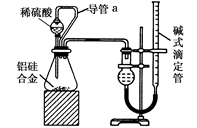
①装置中导管a的作用是:_____________
②实验中准确测得4个数据:实验前铝硅合金的质量为m1 g,实验后残留固体的质量为m2 g,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则通常状况下气体摩尔体积Vm=_______。
近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
①写出步骤(I)反应的化学方程式:
②写出步骤(III)反应的离子方程式:
(2)还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。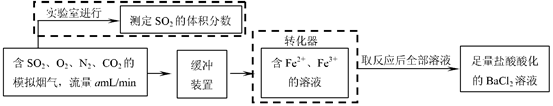

①该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填
序号)。(参考:还原性SO2 > I- >Br->Cl-)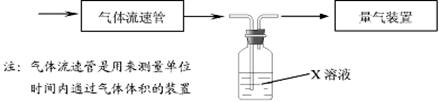
| A.碘的淀粉溶液 | B.酸性高锰酸钾溶液 |
| C.氢氧化钠溶液 | D.氯化钡溶液 |
②若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测
定转化器中SO2氧化成SO42一的转化率,已知气体流速,还需测定的数据是
和加入盐酸酸化的氯化钡溶液后生成沉淀的质量。
(3)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是。
某化学课外小组用海带为原料制取了少量碘水。现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
A. 把盛有溶液的分液漏斗放在铁架台的铁圈上;
B.把50ml碘水和15mlCCl4加入分液漏斗中,并盖好玻璃塞。
C.检验分液漏斗活塞和上口玻璃塞是否漏水;
D.倒转漏斗用力震荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.放开活塞,用烧杯接受溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开使溶液上的凹槽或小孔对准漏斗口上的小孔。
H.静置,分层。
就此实验,完成下列填空:
(1)正确操作步骤的顺序是
(2)上述E步骤的操作中应注意。G步骤操作的目的是
(3)能选用CCl 4从碘水中萃取的原因是
4从碘水中萃取的原因是
如图为实验室制取蒸馏水的装置示意图,根据图示回答问题。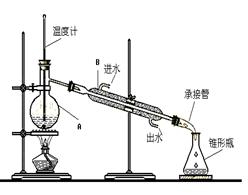
(1)图中的两处明显的错误是
(2)A仪器的名称是
B仪器的名称是
(3)实验时A中除加入少量水外,还需加入少量,其作用是
为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案。请回答每个方案中提出的问题。
【方案I】
(1)称取碳酸钙样品M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积V mL。
问题1:反应结束后,量气管中的显示如右图所示,接下来的操作是:,读出甲管中液面的读数。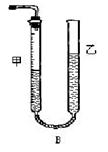
【方案II】
(1)称取碳酸钙样品M g;
(2)用c mol/L 盐酸V mL(过量)溶解样品;
(3)取溶解后的溶液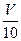 mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
问题2:列出本实验中所用到的主要仪器名称(除铁架台及附件、烧杯之外)。
问题3:碳酸钙纯度计算公式。
问题4:当碳酸钙溶解完全后,少量未溶的SiO2没过滤去,结果得到碳酸钙纯度________(偏大、偏小或无影响)
【方案Ⅲ】
(1)称取碳酸钙样品M g;
(2)加入足量c mol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量c′ mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题5:此方案中不需要的数据是(填选项编号)。
| A.c、V | B.c′、 V′ | C. M′ | D. M |
问题6:为减少实验误差,步骤(3)、(5)过滤后都要对沉淀进行洗涤,如果步骤(3)未经洗涤,则测定的碳酸钙的纯度将(偏大、偏小、无影响,下同);如果步骤(5)未经洗涤,则测定的碳酸钙纯度将。
问题7:判断步骤(4)中Na2CO3溶液是否过量的方法是。
某化学研究性学习小组探讨Fe3+和SO32—之间发生怎样的反应,请你一起参与并协助他们完成实验。
(1)提出猜想:
甲同学认为发生氧化还原反应,其反应方程式为;
乙同学认为发生双水解反应,其反应方程式为2Fe3++3SO32—+6H2O=2Fe(OH)3(胶体)+3H2SO3; ……
(2)实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是。
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
(3)得出结论:
①根据丙同学的实验得出的结论是:;
②实验③中溶液变成血红色的离子方程式为。
(4)拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32-小外,还有。