下列叙述不正确的是
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3
⑥已知2H2(g)+O2(g)=2H2O(l) △H=﹣571kJ·mol﹣1,则氢气的燃烧热为285.5kJ·mol﹣1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
A.②④⑥ B.①③⑤⑦ C.②④⑥⑦ D.⑤⑥⑦
有一合金由X、Y、Z、W四种金属组成,①若将合金放入盐酸中只有Z、Y能溶解;②若将合金于潮湿空气中,表面只出现Z的化合物;③若将该合金作阳极,用X盐溶液作电解质溶液,通电时四种金属都以离子形式进入溶液中,在阴极上只析出X。这四种金属活动性顺序是
| A.Y>Z>W>X | B.Z>Y>W>X |
| C.W>Z>Y>X | D.X>Y>Z>W |
物质的量浓度相同的下列溶液中,NH4+浓度最大的是
| A.NH4Cl | B.NH4HCO3 | C.CH3COONH4 | D.NH4HSO4 |
25℃时,水的电离达到平衡:H2O H++OH-;△H>0,下列叙述正确的是
H++OH-;△H>0,下列叙述正确的是
| A.向水中加入少量固体NaHSO4,c(H+)增大,KW不变 |
| B.向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)降低 |
| C.向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
下列事实中,能用勒沙特列原理来解释的是
| A.由H2(g)、I2(g)、HI(g)组成的混合气体平衡体系加压后颜色加深 |
| B.久置的氯水变成了稀盐酸 |
| C.在FeCl3溶液中加入铁粉防止氧化变质 |
| D.加入催化剂有利于SO2与O2反应制SO3 |
对于可逆反应2NO2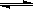 N2O4,下列状态一定是平衡状态的是
N2O4,下列状态一定是平衡状态的是
| A.N2O4和NO2的分子数之比为1∶2 |
| B.N2O4和NO2的浓度相等 |
| C.体系中各组分的浓度不再变化 |
| D.单位时间有1mol N2O4转变为NO2的同时,有1 mol NO2转变为N2O4 |