关于胶体和溶液的区别,下列叙述中正确的是
| A.溶液呈电中性,胶体带有电荷 |
| B.溶液中溶质微粒一定不带电,胶体中分散质微粒带有电荷 |
| C.溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸 |
| D.溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明亮的光带 |
下列说法中正确的是( )
| A.某无色溶液中可能含有下列离子:H+、Cl-、Na+、Fe2+ |
| B.能使石蕊变红的溶液中可能含有Cl-、K+、Na+、NO3- |
| C.取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO42- |
| D.H++OH-===H2O可描述所有酸碱中和反应的实质 |
在两个容积相同的容器中,一个盛有NH3气体,另一个盛有H2和N2的混合气体。在同温同压下,两容器内的气体一定具有相同的是()
| A.原子数 | B.分子数 | C.质量 | D.密度 |
将3.22克Na2SO4 ·10H2O 溶于水中,要使Na+离子数目与水分子数目之比为1:100,则加入水的质量为( )克
A.18 B.36 C 34.2D.37.8
下列溶液中的Cl-浓度与50 mL 1 mol·L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A.150 mL 1 mol·L-1 NaCl溶液 | B.75 mL 2 mol·L-1 CaCl2溶液 |
| C.150 mL 2 mol·L-1 KCl溶液 | D.75 mL 1 mol·L-1 AlCl3溶液 |
体积为V mL,密度为d g/mL,溶质的摩尔质量为M g·mol-1,物质的量浓度为c mol·L-1,溶质的质量分数为a%,溶质的质量为m g。下列式子正确的是( )
| A.m=aV/100d | B.c=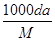 |
C.c= |
D.a%=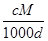 % % |