下列说法中,正确的是
| A.SO2的摩尔质量是64g |
| B.18g H2O在标准状况下的体积小于22.4L |
| C.在标准状况下,20mL NH3与60mL O2所含的分子数比为1:3 |
| D.将40g NaOH溶于1L水中,所得溶液的物质的量浓度为1mol/L |
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL (标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀,下列说法不正确的是( )
| A.该合金中铜与镁的物质的量之比是2∶1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
常温下,甲组中的某种物质能与乙组中的所有物质发生反应,甲组中的该物质是( )
| 甲组 |
①Al(OH)3 ②SiO2 ③ FeCl3溶液 ④ SO2 |
| 乙组 |
a.NaOH溶液 b.浓HNO3 c.氨水 d.氯水 e.H2O2溶液 |
A.① B.② C.③ D.④
下列有关离子方程式推理正确的是( )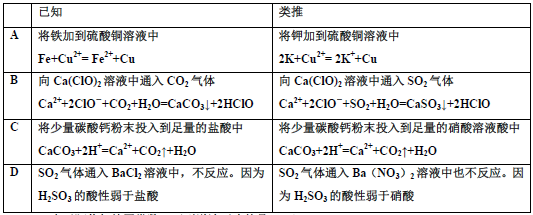
海洋中有丰富的食品、矿产资源、药物和水产资源等(如图所示),下列有关说法不正确的是( )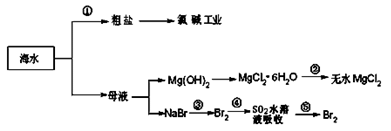
| A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 |
| B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
D.过程①中除去粗盐中的 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
已知氧化性:NO3- >Br2>Fe3+>I2还原性:I- > Fe2+ > Br- > Cl-。
在一种酸性溶液中,可能存在NO3-、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下推测中不正确的是( )
| A.一定有I- | B.可能Fe3+ | C.可能有Cl- | D.肯定没有NO3- |