某元素的原子最外电子层排布是6s26p4,该元素或其化合物不可能具有的性质是
| A.该元素单质可能是导体 |
| B.该元素的最高化合价呈+6价 |
| C.该元素能与氢气反应生成气态氢化物 |
| D.该元素价电子轨道中有2个未成对电子 |
已知下列元素原子半径为:
| 原子 |
N |
S |
O |
Si |
| 半径r/10-10m |
0.75 |
1.02 |
0.74 |
1.17 |
根据以上数据,磷原子的半径可能是
A.0.80×10-10 m B.0.70×10-10 m C.1.10×10-10 m D.1.20×10-10 m
有关化学反应与能量的关系,表述正确的是
| A.化学反应除了生成新物质外,还伴随着能量的变化 |
| B.放热反应不需要加热即可发生 |
| C.需要加热条件的化学反应都是吸热反应 |
| D.化学键断裂释放能量,化学键形成需要吸收能量 |
某主族元素最高价氧化物对应水化物的分子式是H2RO3,则其氢化物的 分子式是
分子式是
| A.RH4 | B.R H3 H3 |
C.H2R | D.HR |
实际存在的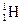 、
、 、
、 、H+和H是
、H+和H是
| A.氢的五种同位素 | B.氢元素的同素异形体 |
| C.氢的五种核素 | D.氢元素的五种不同微粒 |
据报导我国最近合成出多种元素的新同位素,其中一种是 (铪),它的中子数是
(铪),它的中子数是
| A.72 | B.113 | C.185 | D.257 |