常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
| 实验 编号 |
HA的物质的量 浓度(mol·L-1) |
NaOH的物质的量 浓度(mol·L-1) |
混合后溶 液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,从a值大小如何判断HA是强酸还是弱酸?_________________。
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是_______。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=_______ mol·L-1。
(5)某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B===H++HB-
HB- H++B2-。
H++B2-。
在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c (H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(14分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图,完成下列填空:
(1)在电解过程中电解池中所发生总反应的离子方程式为:________,与电源负极相连的电极附近,溶液PH ________。(选填“不变”“升高”或“下降”)
(2)工业食盐中含Ca2+、Mg2+等杂质。精制过程中发生的离子方程式为、。
(3)若粗盐中SO42—含量较高,必须添加钡试剂除去SO42—,该钡试剂可以是 ;
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为了有效除去Ca2+、Mg2+、SO42—,加入试剂的合理顺序为 ;
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 。(填操作名称)除去NaCl。
(10分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
⑴若X、Y都是惰性电极,a是饱和CuCl2溶液,则
①电解池中X极上的电极反应式是________;
②Y电极上的电极反应式是________;检验该电极反应产物的方法是________。
⑵如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①Y电极的材料是________;
②假若电路中有0.04摩尔电子通过时,阴极增重________克。
(9分)根据下列氧化还原反应2FeCl3+Cu===2FeCl2+CuCl2设计一个原电池: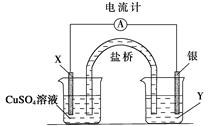
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________;
(2)银电极为电池的________极,发生的电极反应为_________________________;
X电极上发生的电极反应为_________________________;
(3)外电路中的电子是从________电极流向________电极(填具体电极如Ag”)。
(10分)如图所示,水槽中试管内有一枚铁钉,放置数天观察:
(1)铁钉在逐渐生绣。
(2)若试管内液面上升,发生 腐蚀,电极反应:负极:,正极:。
(3)若试管内液面下降,则原溶液呈性,发生的电极反应:正极:。
(6分)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)ΔH=-1 160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。