(10分)某研究性小组借助A-D的仪器装置完成有关实验。
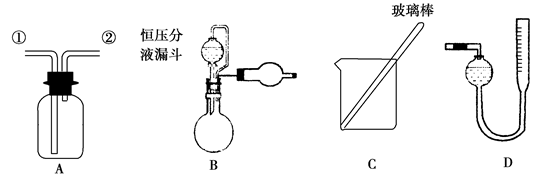
【实验一】收集NO气体。
(1)用装置A收集NO气体,正确的操作是________(填序号)。
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 d.从②口进气,用排气法集气
【实验二】为了探究镀锌薄铁板上的锌的质量分数ω(Zn)和镀层厚度,查询得知锌易溶于强碱:Zn+2NaOH=Na2ZnO2+H2↑。据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(2)选用B和________(填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为VL(标准状况),ω(Zn)=________。
(4)计算镀层厚度,还需要检索的一个物理量是________。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将________(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g。
(6)ω(Zn)=____________。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(7)从实验误差角度分析,方案丙________方案乙(填“优于”、“劣于”或“等同于”)。
为了验证浓H2SO4和木炭在加热时发生反应生成的各种产物,甲、乙两学生分别设计如下实验方案:(图中→表示气体流向)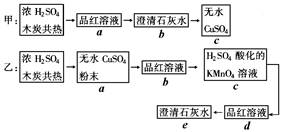
(1)上述方案可达到实验目的的是______________(填“甲”或“乙”)。
(2)具体说明能达到实验目的的方案中,气体通过的各装置(用字母表示)的作用:。
下图所示为苯和溴的取代反应的实验改进后的装置图,其中A为具有支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就会发生反应。该反应中铁屑粉的作用是___________________________,写出A中发生反应的化学方程式(有机物 写结构简式)________________________________________。
写结构简式)________________________________________。
(2)试管C中苯的作用是。反应开始后,观察D和E两支试管,看到的现象为___________________________________________。
(3)F中发生反应的离子方程式是___________________。
(4)在上述整套装置中,采取了防倒吸措施的装置是________________(填字母代号)。
(5)实验室得到粗溴苯后,要用如下操作精制:①蒸馏②水洗③用干燥剂干燥④10% NaOH溶液洗⑤水洗正 确的操作顺序是(填写序号)
确的操作顺序是(填写序号)
| A.①②③④⑤ | B.②④⑤③① |
| C.④②③①⑤ | D.②④①⑤③ |
.已知室温下乙醛的沸点为20.8℃,且与水互溶。用HgSO4做催化剂,在75℃左右,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种:现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、HgO粉末五种物质制取乙醛,装置如下图所示,请回答下列问题;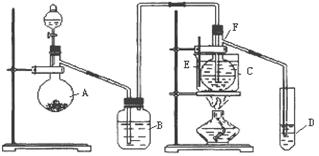
(1)实验开始时,仪器A中盛放电石,B中应装,其作用是。
(2)仪器D中盛放水,其作用是。
(3)蒸馏烧瓶F中应加入HgO和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括HgO在内的各试剂的名称。将HgO加放到F中的操作方法是。
(4)装置图中,加热F的方法叫,所选用温度计F的量程表示正确的是
(填代号)。
| A.0℃~50℃ | B.0℃~100℃ | C.0℃~200℃ | D.0℃~360℃ |
(5)检验乙醛已制出的操作及现象是
。
下列操作或叙述不正确的是(填序号)。
| A.在催化剂存在的条件下,苯和溴水发生反应可生成无色、比水重的液体溴苯 |
| B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验 |
| C.乙醇中含有少量水可加入硫酸铜再蒸馏制得无水乙醇 |
| D.试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,然后加热制取乙酸乙酯 |
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
G.苯酚不小心沾在手上,立即用NaOH溶液清洗
H.某些蛋白质与浓硝酸作用显黄色
(10分) 无水CuSO4在强热下会发生分解反应:
CuSO4 CuO + SO3↑
CuO + SO3↑
2SO3 2
2 SO2↑+ O2↑
SO2↑+ O2↑
某研究性学习小组设计了下图所示装置(夹持仪器已略去),利用D管在反应前后的质量差计算分解的无水CuSO4的质量。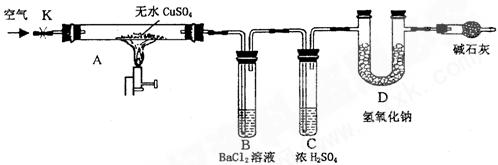
实验步骤:
①称量反应前D 管的质量。
管的质量。
②连接好装置,关闭K,加热硬质玻璃管A一定时间后,停止加热 。
。
③待硬质玻璃管A冷却后,打开K,通入一段时间的空气。
④再称量D管,得其反应前后的质量差为m。
(1)B管中出现的现象是__________________________________________________。
有关离子方程式是__________________________________________________
(2)B管的作用是除去混合气体中的SO3,实验过程中发现B管的温度明显升高,主要原因是______________________
(3)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算分解的无水CuSO4的质量?___________
原因是__________________________________________________________。