下列有关说法错误的是
| A.NA个OH-含有电子10mol |
| B.某元素R一个原子的质量是ag,则其的相对原子质量可表示为a NA |
| C.4L0.5mol/L的NaOH溶液中含有阴离子的数目为2NA |
| D.配制一定物质的量浓度的NaOH溶液时,定容时俯视操作所得溶液浓度偏低 |
下列试剂的保存方法正确的是
| A.氢氟酸保存在玻璃瓶中 ,烧碱溶液存放在带有玻璃塞的试剂瓶中 |
| B.水玻璃存放在滴瓶中,硝酸银溶液保存在无色广口瓶中。 |
| C.少量金属钠保存在煤油中,少量白磷保存在水中。 |
| D.液溴直接存放在棕色滴瓶中,浓硝酸保存在带橡胶塞的无色玻璃瓶中。 |
下列说法不正确的是
| A.铜片在稀硫酸和NaNO3混合溶液中可溶解 |
| B.常温常压下,46gNO2和N2O4混合气体共含有3mol原子 |
| C.光纤通讯中制造光纤的基本原料是SiO2 |
| D.光照氯水有气泡逸出该气体是Cl2 |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.78g 苯含有C=C双键的数目为3NA |
| B.室温下,1LpH=13的Ba(OH)2溶液中,溶液中的OH-离子数目为0.2NA |
| C.0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA |
| D.含2molH2SO4的浓硫酸与足量铜片在加热条件下反应,产生NA个SO2气体分子 |
化学与社会、生活密切相关。对下列现象或事实的解释正确的是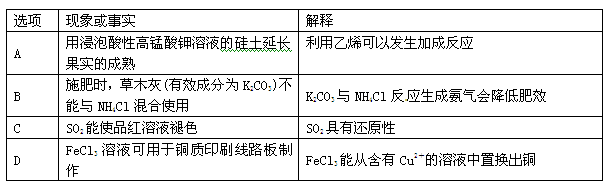
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
| A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 |
| D.电解MgCl2溶液,可制得金属镁 |