(14分)如图是有关钠与水反应及产物检验的实验装置。实验开始时先向管内加入滴有酚酞的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中。回答下列问题:
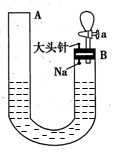
(1)钠与水反应的化学方程式为 。
(2)钠与水反应的现象有很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是 。
②能证明钠的熔点低的现象是 。
③能证明有氢氧化钠生成的现象是 。
④能证明有气体产生的现象是A端液面 (填“A.上升”、“B.下降”或“C.不变”,下同),B端液面 。
⑤钠燃烧产物与H2O反应的化学方程式 。
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS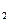 )进行如下实验探究。
)进行如下实验探究。
[实验一]:测定硫元素的含量
I.将m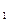 g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:
g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为: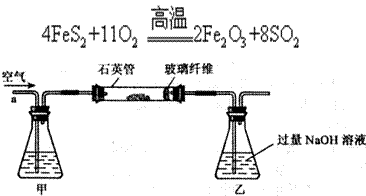
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理: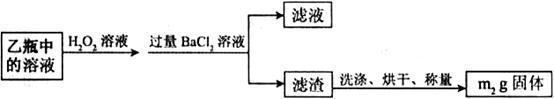
问题讨论:
(1)I中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有________________________、________________________________。
(2)Ⅱ中。所加H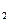 O
O 溶液需足量的理由是________________。
溶液需足量的理由是________________。
(3)该黄铁矿石中硫元素的质量分数为________________。
[实验二]:设计以下实验方案测定铁元素的含量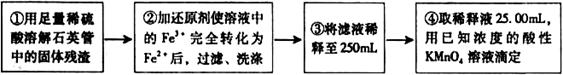
问题讨论:
(4)②中,若选用铁粉作还原剂。你认为合理吗?________。若不合理,会如何影响测量结果:________(若合理,此空不答)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
(6)④中高锰酸钾溶液应放在_____滴定管中;判断滴定终点的现象为________________。
黄铁矿的主要成分是FeS2。测定黄铁矿中FeS2含量的两种方法如下图所示: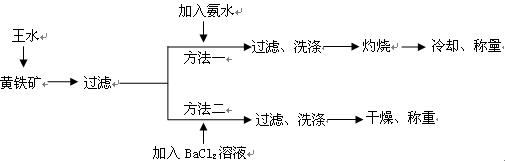
已知:①王水是由1体积的浓硝 酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。
酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。
②黄铁矿和王水反应的方程式为FeS2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
请回答下列问题:
(1)简述实验室配制王水的操作过程_____________________________________
________________________________________________________________。
(2)方法一中过滤、洗涤、灼烧都用到的仪器是_______________。
(3)方法二中要判断BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是_________(填代号)
| A.BaCl2 | B.NaOH | C.Na2SO4 | D.HCl |
(4)实验室利用下列装置和试剂制取少量氯化氢气体试剂:①浓硫酸 ②浓盐酸 ③食盐固体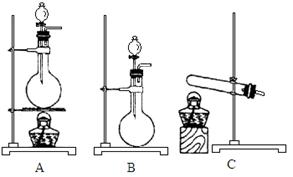
若选用试剂①③,则应选择的装置是___________(填代号,下同);推测发生反应的化学方程式为__________________________________________________;
若选用试剂①②,则宜选择的装置是____________。
(5)方法一中,灼烧时发生反应的化学反应方程式为________________________ ;已知称取黄铁矿样品的质量为1.50g,称得灼烧后固体的质量为0.8g,不考虑操作误差,则该矿石中FeS2的质量分数是________________。
某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
试回答:
(1)该实验中A部分的装置是(填写装置的序号)。
(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
。
(3)写出D装置中发生反应的离子方程式。
(4)该实验存在明显的缺陷,请你提出改进的方法。
(16分)现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你回答相应问题。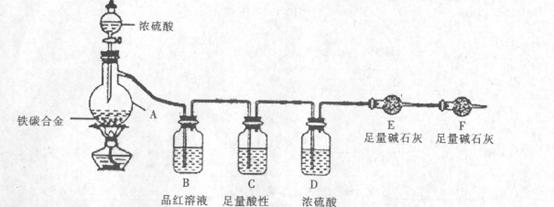
I探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。将mg铁碳合金样品放人A中,再加入适量的浓硫酸。仪器A的名称为。
(2)未点燃酒精灯前,A、B均无明 显现象,其原因是:。
显现象,其原因是:。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。B中的现象是,由此可得到浓硫酸具有性。
(4)反应一 段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是
段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是
Ⅱ测定铁碳合金中铁的质量分数
(5)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。铁碳合金中铁的质量分数为(写表达式),若撤掉装置D,会造成测定结果(填“偏高”、“不变’’或“偏低”)。
(6)某同学认为上述方法较复杂,使用右图所示的装置和其它常用实验仪器测定某些数据即可。该同学的实验方案是:(只需简要写出操作步骤及需要测定的数据,不必计算)。。
苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。现利用如图装置制取苯甲酸甲酯粗产品,再测定苯甲酸甲酯的含量。
实验一:制取苯甲酸甲酯
在圆底烧瓶中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A(用酒精灯加热略)连接仪器并实验。
(1)苯甲酸与甲醇反应的化学方程式为。
(2)要想提高苯甲酸的转化率,可以采取的措施是。
实验二:为测定苯甲酸甲酯的含量,进行了如下操作:
(I)准确称量30.0g苯甲酸甲酯粗品于锥形瓶中,用0.50mol/L 滴定(酚酞做指示剂)。终点时消耗
滴定(酚酞做指示剂)。终点时消耗 溶液的体积为40.0mL;
溶液的体积为40.0mL;
(II)另取30.0g苯甲酸甲酯粗产品于250ml锥形瓶中,加入100ml2.1mol/L 溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时,装置如图所示。待冷却后,用0.50mol/L
溶液混合均匀后,装上冷凝管,在水浴上加热回流约1小时,装置如图所示。待冷却后,用0.50mol/L 滴定过量的
滴定过量的 。终点时消耗盐酸的体积为20.0ml。回答:
。终点时消耗盐酸的体积为20.0ml。回答:
(3)实验(I)中达到滴定终点时的现象是
(4)实验(II)中冷水从冷水凝管的(填a或b)管口通入。
(5)利用实验(I)、(II)测量的数据计算粗产物中苯甲酸甲酯的质量分数为。
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(6)比较有、无浓硫酸存在条件下酯化反应进行的快慢,需要测量的实验数据是。