用NA表示阿伏加德罗常数的值。下列说法中正确的是
| A.2.4 g金属镁变成镁离子时失去的电子数为0.1NA |
| B.2 g氢气中含有的原子数为NA |
| C.3.01×1023个氮气分子中含有的原子数为2NA |
| D.17g氨气中含有的电子数为10NA |
某同学为了使反应2HCl + 2Ag 2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是()
2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是()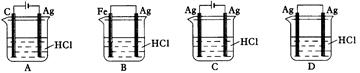
足量的Zn与一定量的盐酸反应,由于反应速率太快,为减慢反应速率,但又不影响生成氢气的总量,可向盐酸中加入适量的物质是()
| A.NaOH固体 | B.CH3COONa固体 | C.NaCl晶体 | D.Na2CO3固体 |
一定条件下反应N2(g)+3H2(g)  2NH3(g)在10 L的密闭容器中进行,测得2 m内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为()
2NH3(g)在10 L的密闭容器中进行,测得2 m内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为()
| A.1.2 mol/(L·min) | B.6 mol/(L·min) |
| C.0.6 mol/(L·min) | D.0.4 mol/(L·min) |
据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极主要发生的反应是()
| A.2H++2e-=H2↑ | B.2H20+02+4e-=40H- |
| C.Fe-2e-=Fe2+ | D.40H--4e-=2H20+02↑ |
在一定温度下,密闭容器中可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是()
2C(g)达到平衡的标志是()
A.C的生成速率与B的消耗速率相等
B.单位时间内生成n molA,同时生成3n molB
C.A、B、C的浓度不再变化
D.A、B、C的浓度之比为1:3:2