在下列给定条件的溶液中,一定能大量共存的离子组是
| A.无色溶液中:K+、Cu2+、OH-、NO3- |
| B.含有大量Fe3+的溶液:Na+、Mg2+、I-、SCN- |
| C.pH=12的溶液中:K+、NH4+、SO42-、NO3- |
| D.水电离产生的c(OH-)=1×10-12mol·L-1的溶液中:K+、Na+、Cl-、NO3- |
在一定温度下,向足量的饱和Na2CO3溶液中加入1.06 g无水碳酸钠,搅拌后静置,最终析出晶体的质量()
| A.等于1.06 g |
| B.大于1.06 g而小于2.86 g |
| C.等于2.86 g |
| D.大于2.86 g |
下列各组中的两物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是( )
| A.Na2O2与CO2 |
| B.Na与O2 |
| C.NaOH与CO2 |
| D.C与O2 |
检验苛性钠溶液中含有少量纯碱的方法是()
| A.加入少量盐酸有气泡冒出 | B.通入少量CO2气体有沉淀生成 |
| C.加热产生气泡 | D.加入BaCl2溶液有白色沉淀生成 |
某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成。将该粉末与足量的盐酸反应有气体X放出,X通过足量的NaOH溶液后体积缩小为原来的一半(相同条件下测定)。若将原混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是()
| A.粉末中一定有Na2O、Na2O2、NaHCO3 | B.粉末中一定不含有Na2CO3、NaCl |
| C.粉末中一定不含有Na2O和NaCl | D.无法肯定粉末中是否含有Na2CO3和NaCl |
按如图所示装置持续通入X气体,并在管口P处点燃,实验结果使澄清石灰水变浑浊,则X、Y可以是()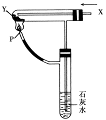
| A.H2和NaHCO3 | B.CO和Na2CO3 |
| C.CO和CuO | D.H2和Fe2O3 |