设NA为阿伏加德罗常数的值,下列说法正确的是
| A.2.0gH218O与D2O的混合物中所含中子数为NA |
| B.常温常压下4.4g乙醛所含σ键数目为0.7NA |
| C.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA |
| D.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
某同学用下列装置制备并检验Cl2的性质.下列说法正确的是 ( )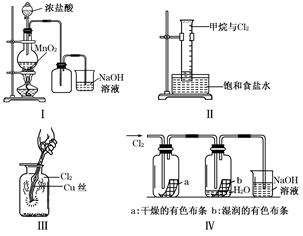
| A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗 |
| B.Ⅱ图中:量筒中发生了加成反应 |
| C.Ⅲ图中:生成蓝色的烟 |
D.Ⅳ图中:湿润的 有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
有关常温下pH均为3的醋酸和硫酸的说法正确的是 ( )
| A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L |
| B.分别加水稀释100倍后,两种溶液的pH仍相同 |
| C.醋酸中的c(CH3COO-)和硫酸中的c(SO)相等 |
| D.分别加入足量锌片,两种溶液生成H2的体积相同 |
25℃时,水的电离达到平衡:H2O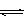 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
下列化学反应的离子方程式正确的是
| A.往碳酸钡中滴加稀盐酸:CO32-+2H+=CO2↑+H2O |
| B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| C.往氨水中滴加氯化铝:Al3++4OH-=[Al(OH)4]- |
| D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
若NA表示阿伏加德罗常数,下列说法正确的是()
| A.含有NA个氖原子的氖气在标准状况下的体积约为11.2L |
| B.2.3gNa被O2完全氧化时,失去电子数为0.1NA。 |
| C.2Llmol·L-1的盐酸中所含氯化氢分子数约为2NA |
| D.标准状况下,5.6LCCl4含有的分子数为0.25NA |